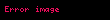Kimyasal denge, iki yönlü bir tepkimede ürünlerin meydana geliş hızının, ürünlerden tekrar tepkimeye girenlerin meydana geliş hızına eşit olduğu durumdur. Böyle denklemlerde tepkimenin her iki tarafa olabileceğini göstermek için çift yönlü ok kullanılır. Genel olarak şöyle göstermek mümkündür:
Burada A ve B tepkimeye giren başlangıç maddeleri, C ve D ise meydana gelen ürünlerdir. Bir denge tepkimesinde çoğu zaman ileri ve geri tepkime hızları birbirine eşittir ve sıfır değildir.
Tarihi
Kimyasal denge kavramı 1803 yılında 'in, kimyasal tepkimelerin tersinin olabileceğini bulmasıyla ortaya çıktı. A ve B girenler, S ve T de ürünler olmak üzere bir denge tepkimesi katsayılarla birlikte şöyle ifade edilir:
1865'te Guldberg ve Waage Berthollet'in fikirlerini geliştirdiler ve tepkime hızlarının derişime bağlı olarak şöyle gösterilebileceğini buldular:
A ve B'nin reaksiyona girme hızı, konsantrasyonlarına (derişimlerine), sıcaklığa ve katalizör mevcudiyetine bağlıdır. Reaksiyon ilerledikçe, A ve B'nin konsantrasyonları ve reaksiyon hızları azalır. C ve D nin konsantrasyonları ve bunların reaksiyona girme hızları da artar. Neticede A ve B'nin reaksiyon hızı, C ve D'nin reaksiyon hızına eşit olur ve eşit hızlarda kesiksiz olarak devam eden reaksiyonlar arasında dinamik bir denge kurulur. Bu, onların konsantrasyonlarının eşit olduğu manasına gelmez. Fakat A, B, C ve D'nin konsantrasyonlarının sabit kalması demektir. Sıcaklık ve basıncın denge üzerinde etkisi vardır. Bunlardan birini veya maddelerden birinin konsantrasyonunun değiştirilmesi halinde, denge sağa veya sola meylederek değişir ve yeni konsantrasyon değerleri meydana gelir.
Reaksiyonların birçoğu iki yönlüdür. Endüstride, istenen ürünlerin lehine reaksiyonu yönlendirmek esastır.
Sıcaklığın artması genellikle her reaksiyonun hızını artırır. Fakat istenen reaksiyonun hızının, ters reaksiyona oranla en yüksek olduğu optimum bir sıcaklık vardır. Eğer gazlar söz konusu ise, basınç değişimi dengeye etki eder. Ürünlerden birinin ortamdan alınması reaksiyonun tamamlanmasına imkân hazırlar.
Denge Sabiti
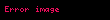
Yukarıdaki tepkime için denge sabiti:
![image]()
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Kimyasal denge iki yonlu bir tepkimede urunlerin meydana gelis hizinin urunlerden tekrar tepkimeye girenlerin meydana gelis hizina esit oldugu durumdur Boyle denklemlerde tepkimenin her iki tarafa olabilecegini gostermek icin cift yonlu ok displaystyle leftrightarrow kullanilir Genel olarak soyle gostermek mumkundur A B C D displaystyle A B leftrightarrow C D Burada A ve B tepkimeye giren baslangic maddeleri C ve D ise meydana gelen urunlerdir Bir denge tepkimesinde cogu zaman ileri ve geri tepkime hizlari birbirine esittir ve sifir degildir TarihiKimyasal denge kavrami 1803 yilinda in kimyasal tepkimelerin tersinin olabilecegini bulmasiyla ortaya cikti A ve B girenler S ve T de urunler olmak uzere bir denge tepkimesi katsayilarla birlikte soyle ifade edilir aA bB sS tT displaystyle alpha A beta B rightleftharpoons sigma S tau T 1865 te Guldberg ve Waage Berthollet in fikirlerini gelistirdiler ve tepkime hizlarinin derisime bagli olarak soyle gosterilebilecegini buldular A ve B nin reaksiyona girme hizi konsantrasyonlarina derisimlerine sicakliga ve katalizor mevcudiyetine baglidir Reaksiyon ilerledikce A ve B nin konsantrasyonlari ve reaksiyon hizlari azalir C ve D nin konsantrasyonlari ve bunlarin reaksiyona girme hizlari da artar Neticede A ve B nin reaksiyon hizi C ve D nin reaksiyon hizina esit olur ve esit hizlarda kesiksiz olarak devam eden reaksiyonlar arasinda dinamik bir denge kurulur Bu onlarin konsantrasyonlarinin esit oldugu manasina gelmez Fakat A B C ve D nin konsantrasyonlarinin sabit kalmasi demektir Sicaklik ve basincin denge uzerinde etkisi vardir Bunlardan birini veya maddelerden birinin konsantrasyonunun degistirilmesi halinde denge saga veya sola meylederek degisir ve yeni konsantrasyon degerleri meydana gelir Reaksiyonlarin bircogu iki yonludur Endustride istenen urunlerin lehine reaksiyonu yonlendirmek esastir Sicakligin artmasi genellikle her reaksiyonun hizini artirir Fakat istenen reaksiyonun hizinin ters reaksiyona oranla en yuksek oldugu optimum bir sicaklik vardir Eger gazlar soz konusu ise basinc degisimi dengeye etki eder Urunlerden birinin ortamdan alinmasi reaksiyonun tamamlanmasina imkan hazirlar Denge SabitiaA bB cC dD displaystyle aA bB leftrightarrow cC dD Yukaridaki tepkime icin denge sabiti K C c D d A a B b displaystyle K frac C c D d A a B b
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans