Konukçu-konuk kimyası; Supramoleküler kimyada tam kovalent bağlar dışındaki kuvvetler tarafından benzersiz yapısal ilişkilerde bir arada tutulan iki veya daha fazla molekül ya da iyondan oluşan kompleksleri tanımlar. Kovalent olmayan bağlanma yoluyla moleküler tanıma ve etkileşim fikrini kapsar. Kovalent olmayan bağlanma, proteinler gibi büyük moleküllerin 3 boyutlu yapısının korunmasında kritik öneme sahiptir ve büyük moleküllerin spesifik olarak ancak geçici olarak birbirine bağlandığı birçok biyolojik süreçte yer alır.
Kovalent olmayan etkileşimler kabaca daha elektrostatik veya dağıtıcı katkılara sahip olanlara bölünebilse de, yaygın olarak bahsedilen birkaç kovalent olmayan etkileşim türü vardır: iyonik bağ, hidrojen bağ, van der Waals kuvvetleri ve hidrofobik etkileşimler.


Genel bakış
Konukçu-konuk kimyası, bir konukçu molekülün bir konuk molekül veya iyon ile kimyasal bir bileşik oluşturduğu supramoleküler kimyanın bir dalıdır. Bileşiğin iki bileşeni kovalent olmayan kuvvetlerle, en yaygın olarak hidrojen bağıyla bir arada tutulur. Konuçu ve konuk arasındaki bağlanma genellikle ilgili iki gruba özeldir. Bu komplekslerin oluşumu, moleküler tanıma konusunun merkezindedir.
Konukçu ve konukun birbirinden ayrı olduğu bağlanmamış durum arasında bir denge vardır ve yapısal olarak tanımlanmış bir konukçu-konuk kompleksinin bulunduğu bağlı durum:
- H = "konukçu", G = "konuk", HG = "konukçu-konuk kompleksi"
"Konukçu" bileşeni, daha büyük molekül olarak kabul edilebilir ve daha küçük olan "konuk" molekülünü kapsar. Biyolojik sistemlerde benzer konukçu ve konuk terimleri, genellikle sırasıyla enzim ve substrat olarak adlandırılır.
Belirli işlevleri ve görevleri yerine getiren sentetik sistemler tasarlamak için konukçu ile konuk arasındaki bağlanmanın termodinamiğini anlamak çok önemlidir. Kimyagerler, farklı bağlanma etkileşimlerinin enerji alışverişine odaklanıyor ve NMR spektroskopisi, UV spektroskopi ve izotermal titrasyon kalorimetrisi gibi çeşitli teknikleri kullanarak bu kovalent olmayan etkileşimlerin temel kökenlerini ölçmek için bilimsel deneyler geliştirmeye çalışıyorlar. Bağlanma sabit değerlerinin kantitatif analizi, faydalı termodinamik bilgiler sağlar.
Konukçu-konuk etkileşimlerinin termodinamik prensipleri
Konukçu-konuk kimyasının termodinamik faydaları, konukçu ve konuk moleküller arasındaki etkileşime bağlı olarak genel Gibbs serbest enerjisinin daha düşük olduğu fikrinden kaynaklanmaktadır. Kimyacılar, supramoleküler kimyada bulunan bu kovalent olmayan etkileşimlerin enerjisini ve termodinamik özelliklerini kapsamlı bir şekilde ölçmeye çalışıyorlar ve bunu yaparak, supramoleküler yapı üzerinde genel bir etki yaratmak için kullanılan bu çok sayıda, küçük ve kovalent olmayan kuvvetin birleşimsel sonucu hakkında daha fazla bilgi edinmeyi umuyorlar.
Bir ilişki sabiti, 
Buradaki {HG}, kompleksin dengedeki termodinamik aktivitesidir. {H} konukçu aktivitesini ve {G} konuğun aktivitesini temsil eder. 


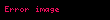
Pratikte denge sabiti genellikle konsantrasyonlar olarak tanımlanır.
Bu tanım kullanıldığında, aktivite katsayılarının bölümünün sayısal bir değeri olduğu ima edilmektedir. Daha sonra denge sabiti 

Bu bariz paradoks, 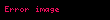
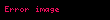
Büyük bir 
Bağlanma sabit değerlerinin belirlenmesi
Basit konukçu-konuk kompleksi
Konukçu ve konuk moleküller bir kompleks oluşturmak için birleştiğinde denge şu şekilde temsil edilir:
ve denge sabiti K şu şekilde tanımlanır:
Burada [X], X kimyasal türünün konsantrasyonunu gösterir (tüm aktivite katsayılarının sayısal değerlerinin 1 olduğu varsayılır). Herhangi bir veri noktasındaki kütle dengesi denklemleri,


Hesaplamadaki bir sonraki adım, gözlemlenen 

ve bu, stabilite sabiti değeri K ve HG türünün kimyasal kayması (nmr verileri) veya molar emilimi (uv/vis verileri) gibi bir parametre ile ilgili olarak en aza indirilebilir. Küçültme, dahili SOLVER yardımcı programı kullanılarak EXCEL gibi bir elektronik tablo uygulamasında gerçekleştirilebilir.
Bu prosedür, yalnızca 1:1 eklentisinin oluşan tek karmaşık tür olduğu kesin olduğunda kullanılmalıdır. Bu iddianın geçerliliğine ilişkin basit bir kontrol, kalıntıların 
Nükleer manyetik rezonans (NMR) verileri
Nükleer manyetik rezonans (NMR) spektrumları ile, bir reaktif molekülünde bulunan belirli bir atomdan ve bu reaktifin bir veya daha fazla kompleksinden kaynaklanan gözlenen kimyasal kayma değeri δ, bu kimyasal türlerin tüm kaymalarının konsantrasyon ağırlıklı ortalaması olacaktır. NMR zaman ölçeğinde kimyasal değişimin hızlı olduğu varsayılır. Mol fraksiyonları terimleri,



Bu ifade, Beer'in yasası ile aynı matematiksel forma sahiptir. Kimyasal kayma değerleri, emmenin birden fazla dalga boyunda ölçülebilmesine benzer bir şekilde birden fazla çekirdek için elde edilebilir. Bu bağlamda kullanılabilecek tipik izotoplar 1H 13C ve 31P'dir. 1H kimyasal kayma değerlerini ölçerken döteryumlanmış bir çözücü kullanmak olağandır.
Absorbans verileri

Beer-Lambert yasasına göre her türün absorbansının o türün konsantrasyonu ile orantılı olduğu varsayılmaktadır.
Burada λ bir dalga boyudur; 

Floresans verileri
Bu tür verilerin işlenmesi, absorbans verilerinin işlenmesine benzer. Aslında floresan yoğunluğu ve tür konsantrasyonları arasındaki ilişkiyi tanımlayan denklem çok benzerdir.
Burada 
Kalorimetre
Konuku içeren çözeltiye bir miktar konukçu çözeltisi eklendiğinde ortaya çıkan ısı, her reaksiyondan gelen katkıların toplamıdır.
Burada; 



İzotermal titrasyon kalorimetrisi, hem bir denge sabitinin hem de karşılık gelen standart reaksiyon entalpisinin değerlerini belirlemek için yaygın olarak kullanılır. ITC aletlerinin üreticileri, bu miktarların deneysel veri değerlerinden elde edilebileceği bazı yazılımları tedarik etmektedir.
Genel kompleksleşme reaksiyonu
Bir konukçu, H ve bir konuk G'yi içeren her denge için
denge sabiti 
Serbest konsantrasyonların 

Daha sonra, her bir kompleks türünün konsantrasyonları da 
Standart entalpi ve entropi değişim değerlerinin belirlenmesi
İlk olarak, bir çözümün tek kompleks HG ile dengede olan belirli miktarlarda bir konukçu H ve bir konuk G içerdiği sistem düşünülür.
Sonra, dengede bir konukçu ve konuk karışımına az miktarda konuk eklendiği varsayılır. Bu durumda yeni bir denge kurulacak ve bir miktar Q ısısı gelişecektir. Bu miktar, araçsal faktörler için ölçüldüğünde ve düzeltildiğinde, çözelti içinde mevcut olan kompleks HG miktarındaki değişiklikle ilgilidir.
ΔH⊖, standart oluşum entalpisidir, yani kompleksin 1 mol oluşumu için entalpidir; HG ve 
Denge sabitinin değeri 

K'nin değeri bilinmiyorsa, 

Not: Standart entalpi değişimini hesaplamak için van 't Hoff denklemi artık kullanılmamaktadır, çünkü bu yöntem kullanılarak elde edilen değer büyük olasılıkla aşırı hataya maruz kalacaktır.
Genel olarak, m kompleksleri oluştuğunda, k'inci titrasyon noktasında geliştirilen ısı, bir reaksiyon ürününün konsantrasyonundaki bir değişiklikten kaynaklanan katkıların toplamıdır.
Her reaksiyon ürününün oluşumu için standart bir entalpi değişimi ve bir denge sabiti belirlenecek 2m parametresi vardır. ITC cihaz üreticileri, birden çok parametre değerinin hesaplanabileceği birkaç özel yazılım ürünü tedarik etmektedir. HypΔH gibi genel durum için bilgisayar programları Afinimetre ITC'de mevcuttur.
Her bir standart entalpi değişiminin ve denge sabitinin değerleri belirlendiğinde, karşılık gelen standart entropi değişiminin değeri şu ifadeden türetilebilir.
T verilen sıcaklığında.
Deneysel teknikler
Nükleer manyetik rezonans
Nükleer manyetik rezonans (NMR), analitik kimyadaki en güçlü spektroskopik tekniklerden biridir. Agregalar, iyon çifti veya kapsüllenmiş sistemler şeklinde var olan çeşitli komplekslerin yapılarını aydınlatmak için konukçu-konuk kompleksleri çalışmaları için önemli bir araçtır. Adından da anlaşılacağı gibi NMR, moleküllerdeki farklı çekirdekleri (en yaygın olarak proton) kimyasal kaymalarını ölçerek tanımlar. İki molekülün bağlanma aktivitesi, elektronik ortamlarında önemli bir değişikliğe neden olur. Bu, NMR spektrumundaki sinyallerde bir kaymaya yol açar ve bu temel ilkeden, konukçu-konuk kimyası fenomenini incelemek için kullanılır. Konukçu-konuk bağlanmasının itici güçleri, hidrojen bağı ve pi-pi etkileşimi gibi moleküller arasındaki çeşitli ikincil etkileşimlerdir. Böylelikle NMR, bir konukçu-konuk kompleksinde bu etkileşimlerin varlığını tespit etmek için önemli bir teknik olarak hizmet eder.

Önceki NMR çalışmaları, farklı konukların konuçulara bağlanması hakkında yararlı bilgiler vermiştir. Fox vd. piridin molekülleri ile poliamidoamin (PAMAM) dendrimeri arasındaki hidrojen bağı etkileşimlerini amin ve amid gruplarının kimyasal kaymasına göre hesapladı. Benzer bir çalışmada Xu ve vd. titre edilmiş karboksilat bazlı G4 PAMAM dendrimer (konukçu) çeşitli amin bazlı ilaçlar (konuklar) ile ve dendrimerin kimyasal kaymalarını izledi. 2D-NOESY NMR teknikleriyle bağlantılı olarak, ilaçların dendrimerler üzerindeki konumunu ve işlevselliğin ilaçların bağlanma afinitesi üzerindeki etkisini tam olarak tespit edebildiler. Katyonik ilaç moleküllerinin anyonik dendrimerlerin yüzeyine elektrostatik etkileşimlerle bağlandığını, oysa anyonik bir ilacın dendrimerlerin hem çekirdeğinde hem de yüzeyinde lokalize olduğunu ve bu etkileşimlerin gücünün moleküllerin pKa değerlerine bağlı olduğunu gösteren kesin kanıtlar buldular.
Farklı bir çalışmada Sun ve vd. cucurbituril ile rutenyum trisbipiridil-viologen moleküllerinin konukçu-konuk kimyasını inceledi. Viologen üzerindeki piridin protonlarının kimyasal değişimlerini izlerken, 1:1 komplekslerinin bağlanma modlarının farklı cucurbituril molekülleri için tamamen farklı olduğunu bulmuşlardır.
Konukçu ve konuk arasındaki bağlanmayı analiz ederken akılda tutulması gereken önemli bir faktör, bağlanma olayının zamanına kıyasla veri toplama için geçen zamandır. Çoğu durumda, bağlanma olayları, veri edinme zaman ölçeğinden çok daha hızlıdır; bu durumda çıktı, ayrı moleküller ve kompleks için ortalama bir sinyaldir. NMR zaman ölçeği milisaniye mertebesinde olup, bazı durumlarda bağlanma reaksiyonunun hızlı olduğu durumlarda tekniğin doğruluğunu sınırlar.
Ultraviyole-görünür spektroskopi

Ultraviyole ile görülebilir spektroskopi, çeşitli moleküllerin bağlanma aktivitesini araştırmanın en eski ve en hızlı yöntemlerinden biridir. UV ışığının absorpsiyonu pikosaniye zaman ölçeğinde gerçekleşir, bu nedenle türlerden gelen bireysel sinyaller gözlemlenebilir. Aynı zamanda, absorpsiyonun yoğunluğu, türlerin konsantrasyonu ile doğrudan ilişkilidir, bu da ilişki sabitinin kolay hesaplanmasını sağlar. En yaygın olarak, ya konukçu ya da konuk, UV-ışığına karşı saydam iken, diğer molekül UV-duyarlıdır. UV'ye duyarlı moleküllerin konsantrasyonundaki değişiklik böylece izlenir ve birleşme sabitinin doğrudan hesaplanabildiği Benesi-Hildebrand yöntemi kullanılarak düz bir çizgiye yerleştirilir.
Benesi-Hilderbrand yöntemi, konukçu ve konuk arasında 1:1'lik bir stoikiometri varsaydığından, komplekslerin stokiyometrisi hakkında ek bilgi de elde edilir. Veriler, ancak kompleks oluşumu da benzer bir 1:1 stokiyometrisini takip ederse düz bir çizgi verecektir. Benzer hesaplamanın yakın tarihli bir örneği Sun vd. tarafından yapıldı, burada rutenyum trisbipiridil-viologen moleküllerini kabakturillerle titre ettiler ve kabakgil moleküllerinin göreceli absorbansını belirli bir dalga boyundaki toplam konsantrasyonunun bir fonksiyonu olarak çizdiler. Veriler, 
Bir uzantı olarak, konukçu ve konuk arasındaki bağlanma olaylarının kinetiğini anlamak için veriler farklı stokiyometrilere sığdırılabilir. Bu sonuç, diğer parametrelerle birlikte çeşitli konuk imidazoller ve amino asit metil esterleri ile baryum içeren kron eter köprülü kiral heterotrinükleer salen Zn(II) kompleksi 
İzotermal titrasyon kalorimetrisi
Spektroskopik teknikler bağlanma sabiti 


Deneyin izotermal koşullar altında yapılması şarttır; bu nedenle dizotermal kalorimetri adı verilir. Prosedür, konvansiyonel bir titrasyon prosedürüne benzer olup, burada konukçuya sırayla konuka eklenir ve emilen veya gelişen ısı boş bir solüsyonla karşılaştırıldığında ölçülür. Açığa çıkan toplam ısı Q, denklem tarafından 


Herhangi biri şu şekilde basitleştirilebilir:

olmak üzere,
= Konukçunun ilk molar konsantrasyonu
= Konukun molar konsantrasyonu
= Vessel hacmi
Yukarıdaki denklem doğrusal olmayan regresyon analizi ile çözülerek 





Uygulamalar
Raman spektroskopisi
Raman spektroskopisi, üzerine monokromatik ışık geldiğinde bir Raman saçılma etkisi sergileyen moleküllerin çalışmasında kullanılan spektroskopik bir tekniktir. Bir Raman sinyali almanın temel şartı, olay ışığının kimyasal türlerde temel durumundan sanal enerji durumuna elektronik bir geçişe neden olmasıdır, bu da temel duruma döndüğünde bir foton yayar. Emilen ve yayılan foton arasındaki enerji farkı, elektronik ortamına bağlı olarak her kimyasal tür için benzersizdir. Bu nedenle, moleküller arasındaki bağlanma neredeyse her zaman elektronik ortamlarında bir değişiklikle sonuçlandığından, teknik, çeşitli bağlanma olaylarının incelenmesi için önemli bir araç olarak hizmet eder. Bununla birlikte, Raman spektroskopisini benzersiz bir teknik yapan şey, yalnızca molekülün polarizasyonundaki bir değişikliğin eşlik ettiği geçişlerin Raman aktif olmasıdır. Raman spektrumlarından türetilen yapısal bilgiler, kompleksin elektronik konfigürasyonu hakkında, bireysel konukçu ve konuk moleküllere kıyasla çok spesifik bilgiler verir.

Çözelti fazlı Raman spektroskopisi genellikle zayıf bir saçılma enine kesiti ile sonuçlanır. Bu nedenle, yüzeyde geliştirilmiş Raman spektroskopisi ve Rezonans Raman spektroskopisi gibi Raman sinyallerini geliştirmek için son gelişmeler sağlanmıştır. Bu tür teknikler, analit-reseptör bağlanma olaylarının nicelleştirilmesi için ek bir amaca hizmet ederek, gerçekte çözümlerde yer aldıkları konukçu-konuk kompleksleşmesi olgusunun daha ayrıntılı bir resmini verir. Yakın tarihli bir buluşta, Flood vd. Raman spektroskopisi ve SERS kullanılarak tetrathiafulvalene (TTF) ve cyclobis'in (paraquat-p-phenylene) bağlanma gücünü belirledi. Bu alandaki önceki çalışma, ilişki kuvvetlerinin nicel ölçümlerinden ziyade, sonuçta ortaya çıkan kompleksin bağlanması ve yapısı hakkında bilgi sağlamayı amaçlamıştır. Araştırmacılar, 1 mM kadar düşük konsantrasyonlara sahip çözeltilerden tespit edilebilir sinyaller alabilmek için Rezonans Raman spektroskopisi kullanmak zorunda kaldılar. Özellikle, Raman bantlarının yoğunluğunu, foto-uyarılmış durumdaki kompleksin geometrisiyle ilişkilendirdiler. Ultraviyole görünür spektroskopiye dayalı titrasyona benzer şekilde, bağlanma sabitini "Raman titrasyonu" ile hesapladılar ve bağlanma eğrilerini 1:1 modellere uydurarak -5.7±0.6 kcal/mol 
Cooperativity
Bir ligandın birden fazla bağlanma yeri olan bir reseptöre bağlandığı zaman, ligand gelen ligandlar için afinitede bir azalmaya veya artışa neden olarak tanımlanır. Sonraki ligandların bağlanmasında bir artış varsa, pozitif cooperativity olarak kabul edilir. Bağlanmada bir azalma gözlenirse, bu negatif cooperativity'dir. Pozitif ve negatif cooperativity örnekleri sırasıyla hemoglobin ve aspartat reseptörüdür.

Son yıllarda, pozitif veya negatif cooperativity'i ayırt eden matematiksel parametreleri tanımlamak için cooperativity'in termodinamik özellikleri incelenmiştir. Geleneksel Gibbs serbest enerji denklemi şu şekildedir: 
olmak üzere,
= A bağlanmasının serbest enerjisi
= B bağlanmasının serbest enerjisi
= A ve B bağlı için serbest bağlanma enerjisi
= Bağlanmanın serbest enerjilerinin toplamı




Süperiletkenlik
Düşük sıcaklıklarda ve yüksek basınçlarda, bizmutun bir konukçu-konuk yapısı sergilediği bulunmuştur. Bu şaşırtıcı bir şekilde güçlü bir bağlantı süper iletkenliğine yol açar.
Biyolojik uygulama

İlaç dağıtım sistemlerindeki dendrimerler, çeşitli konukçu-konuk etkileşimlerine bir örnektir. Konukçu ve konuk, sırasıyla dendrimer ve ilaç arasındaki etkileşim, hidrofobik veya kovalent olabilir. Konukçu ve konuk arasındaki hidrofobik etkileşim "kapsüllenmiş" olarak kabul edilirken, kovalent etkileşimlerin konjuge olduğu kabul edilir. Tıpta dendrimerlerin kullanımının, ilacın çözünürlüğünü ve biyoyararlanımını artırarak ilaç dağıtımını iyileştirdiği gösterilmiştir. Bir arada, dendrimerler hem hücresel alımı hem de hedefleme yeteneğini artırabilir ve ilaç direncini azaltabilir.
Çeşitli NSAID'lerin çözünürlüğü, PAMAM dendrimerleri içinde kapsüllendiğinde artar. Bu çalışma, NSAID çözünürlüğünün artmasının, PAMAM'daki yüzey amin grupları ile NSAID'lerde bulunan karboksil grupları arasındaki elektrostatik etkileşimlerden kaynaklandığını göstermektedir. Çözünürlükteki artışa katkıda bulunanlar, ilaçlardaki aromatik gruplar ile dendrimerin iç boşlukları arasındaki hidrofobik etkileşimlerdir. Bir ilaç bir dendrimer içinde kapsüllendiğinde, spesifik olmama ve toksisite dahil olmak üzere fiziksel ve fizyolojik özellikleri değişmeden kalır. Bununla birlikte, dendrimer ve ilaç kovalent olarak birbirine bağlandığında, spesifik doku hedeflemesi ve kontrollü salım oranları için kullanılabilir. Dendrimer yüzeyler üzerinde birden fazla ilacın kovalent konjugasyonu bir çözünmezlik sorunu oluşturabilir.
Bu prensip aynı zamanda kanser tedavisi uygulaması için de çalışılmaktadır. Çeşitli gruplar, aşağıdakiler gibi kanser önleyici ilaçları kapsülledi: Camptothecin, Methotrexate ve Doxorubicin. Bu araştırmalardan elde edilen sonuçlar, dendrimerlerin suda çözünürlüğünü artırdığını, salım hızını yavaşlattığını ve muhtemelen ilaçların sitotoksisitesini kontrol ettiğini göstermiştir.Cisplatin, yukarıda listelenenlerle aynı farmakolojik sonuçlara yol açan PAMAM dendrimerlerine konjuge edilmiştir, ancak konjugasyon ayrıca intravenöz uygulamada katı tümörlerde sisplatin birikmesine neden olmuştur.
Algılama
Geleneksel olarak, kimyasal algılamaya, bir bağlayıcı yoluyla bir reseptöre kovalent olarak bağlı bir gösterge içeren bir sistemle yaklaşılmıştır. Analit bağlandığında, gösterge rengi veya floresanları değiştirir. Bu teknik, gösterge-ayırıcı-alıcı (ISR) yaklaşımı olarak adlandırılır. ISR'nin tersine, Gösterge Yer Değiştirme Testi (IDA) bir reseptör, gösterge ve bir analit arasında kovalent olmayan bir etkileşim kullanır. ISR'ye benzer şekilde, IDA da kolorimetrik (C-IDA) ve floresans (F-IDA) göstergeleri kullanır. Bir IDA tahlilinde, bir reseptör, gösterge ile inkübe edilir. Analit karışıma eklendiğinde gösterge ortama salınır. Gösterge serbest bırakıldığında, rengi veya floresanları değiştirir.

IDA, geleneksel ISR kimyasal algılama yaklaşımına göre çeşitli avantajlar sunar. İlk olarak, göstergenin reseptöre kovalent olarak bağlanmasını gerektirmez. İkincisi, kovalent bağ olmadığı için aynı reseptörle çeşitli göstergeler kullanılabilir. Son olarak, analizin kullanılabileceği ortam çeşitlidir.

C-IDA gibi kimyasal algılama tekniklerinin biyolojik etkileri vardır. Örneğin protamin, herapinin antikoagülan aktivitesine karşı hareket eden, kardiyopulmoner cerrahiden sonra rutin olarak uygulanan bir pıhtılaştırıcıdır. Plazma örneklerindeki protamini ölçmek için kolorimetrik yer değiştirme deneyi kullanılır. Azure A boya bağlı olmadığında mavidir, ancak herapine bağlandığında mor renk gösterir. Azure A ve heparin arasındaki bağlanma zayıf ve tersine çevrilebilir. Bu, protaminin Azure A'nın yerini almasına izin verir. Boya serbest bırakıldığında mor bir renk gösterir. Boyanın yer değiştirme derecesi, plazmadaki protamin miktarı ile orantılıdır.
F-IDA, Kwalczykowski ve meslektaşları tarafından E.coli'deki helikaz aktivitelerini izlemek için kullanılmıştır. Bu çalışmada gösterge olarak tiyazol turuncu kullandılar. Helikaz, ssDNA yapmak için dsDNA'yı çözer. Tiyazol turuncunun floresan yoğunluğu, ssDNA'dan daha büyük bir dsDNA afinitesine sahiptir ve flüoresans yoğunluğu, bağlı olmadığından daha dsDNA'ya bağlandığında artar.
Konformasyonel anahtarlama
Kristal bir katı, geleneksel olarak, atomik bileşenlerinin hareketlerinin titreşim dengesiyle sınırlı olduğu statik bir varlık olarak görülmüştür. Grafitin elmasa dönüşümünden görüldüğü gibi, fiziksel veya kimyasal basınç altında katıdan katıya dönüşüm gerçekleşebilir. Yakın zamanda, bir kristal düzenlemesinden diğerine dönüşümün işbirliğine dayalı bir şekilde gerçekleştiği öne sürülmüştür. Bu çalışmaların çoğu, organik veya metal-organik bir çerçeveyi incelemeye odaklanmıştır. Makromoleküler kristalin dönüşüm çalışmalarına ek olarak, organik çözücüler varlığında konformasyonlarını değiştirebilen tek kristal moleküller üzerinde de çalışmalar vardır. Bir organometalik kompleksin, çözücü buharlarına maruz kalıp kalmadığına bağlı olarak çeşitli yönelimlere dönüştüğü gösterilmiştir.
Çevresel uygulamalar
Tehlikeli maddeleri ortamdan uzaklaştırmak için konukçu-konuk sistemleri kullanılmıştır. Çeşitli kimyasal konukları yakalamak için farklı boyutlarda ve farklı şekillerde yapılabilirler. Uygulama, p-tert-butycalixarene'nin sezyum iyonunu yakalayabilmesidir. Sezyum-137 radyoaktiftir ve onu nükleer atıklardan verimli bir şekilde uzaklaştırma ihtiyacı vardır. Konukçu-konuk kimyası, kanserojen aromatik aminleri ve bunların N-nitroso türevlerini sudan uzaklaştırmak için de kullanılmıştır. Bu atık malzemeler birçok endüstriyel işlemde kullanılır ve pestisitler, ilaçlar ve kozmetikler gibi çeşitli ürünlerde bulunur.
Kaynakça
- ^ Steed, Jonathan W.; Atwood, Jerry L. (2009). Supramolecular Chemistry (2nd. bas.). Wiley. s. 1002. ISBN .
- ^ Lodish, H.; Berk, A.; Kaiser, C. (2008). Molecular Cell Biology. ISBN .
- ^ Freeman, Wade A. (1984). "Structures of the p-xylylenediammonium chloride and calcium hydrogensulfate adducts of the cavitand 'cucurbituril', C36H36N24O12". . 40: 382-387. doi:10.1107/S0108768184002354.
- ^ Valdés, Carlos; Toledo, Leticia M.; Spitz, Urs; Rebek, Julius (1996). Structure and Selectivity of a Small Dimeric Encapsulating Assembly. Chem. Eur. J. 2. ss. 989-991. doi:10.1002/chem.19960020814.
- ^ a b c d e Anslyn, Eric V.; Dougherty, Dennis A. (2005). Modern Physical Organic Chemistry. MacMillan. ISBN .
- ^ Piñeiro, Á.; Banquy, X.; Pérez-Casas, S.; Tovar, É.; García, A.; Villa, A.; Amigo, A.; Mark, A. E.; Costas, M. (2007). "On the Characterization of Host–Guest Complexes: Surface Tension, Calorimetry, and Molecular Dynamics of Cyclodextrins with a Non-ionic Surfactant". Journal of Physical Chemistry B. 111 (17): 4383-92. doi:10.1021/jp0688815. (PMID) 17428087.
- ^ Hu, J; Cheng, Y; Wu, Q; Zhao, L; Xu, T (2009). "Host–Guest Chemistry of Dendrimer-Drug Complexes. 2. Effects of Molecular Properties of Guests and Surface Functionalities of Dendrimers". . 113 (31): 10650-10659. doi:10.1021/jp9047055.
- ^ Santo, M; Fox, M (1999). "Hydrogen bonding interactions between Starburst dendrimers and several molecules of biological interest". . 12 (4): 293-307. doi:10.1002/(SICI)1099-1395(199904)12:4<293::AID-POC88>3.0.CO;2-Q.
- ^ a b c Sun, S; Zhang, R; Andersson, S; Pan, J; Zou, D; Åkermark, Björn; Sun, Licheng (2007). "Host–Guest Chemistry and Light Driven Molecular Lock of Ru(bpy)3-Viologen with Cucurbit[7-8]urils". . 111 (47): 13357-13363. doi:10.1021/jp074582j.
- ^ Zhu; Ruan, Wen-Juan; Chen, Jia-Mei; Zhang, Ying-Hui; Zhu, Zhi-Ang (1989). "Spectroscopy, NMR and DFT studies on molecular recognition of crown ether bridged chiral heterotrinuclear salen Zn(II) complex". . 62 (4–5): 886-895. Bibcode:2005AcSpA..62..886G. doi:10.1016/j.saa.2005.03.021.
- ^ Brandts; Williston, S; Brandts, J; Lin, L (1989). "Rapid measurements of Binding Constants and Heats of binding Using a New Titration Calorimeter". . 179: 131-137. doi:10.1016/0003-2697(89)90213-3.
- ^ Sikora, C; Turner, R (2005). "Investigation of Ligand Binding to the Multidrug Resistance Protein EmrE by Isothermal Titration Calorimetry". . 88 (1): 475-482. Bibcode:2005BpJ....88..475S. doi:10.1529/biophysj.104.049247. (PMC) 1305024 $2. (PMID) 15501941.
- ^ Witlicki, Edward H.; Hansen, Stinne W.; Christensen, Martin; Hansen, Thomas S.; Nygaard, Sune D.; Jeppesen, Jan O.; Wong, Eric W.; Jensen, Lasse; Flood, Amar H. (2009). "Determination of Binding Strengths of a Host–Guest Complex Using Resonance Raman Scattering". Journal of Physical Chemistry A. 113 (34): 9450-9457. Bibcode:2009JPCA..113.9450W. doi:10.1021/jp905202x. (PMID) 19645430.
- ^ Witlicki, Edward H.; Andersen, Sissel S.; Hansen, Stinne W.; Jeppesen, Jan O.; Wong, Eric W.; Jensen, Lasse; Flood, Amar H. (2010). "Turning on Resonant SERRS Using the Chromophore-Plasmon Coupling Created by Host–Guest Complexation at a Plasmonic Nanoarray". Journal of the American Chemical Society. 132 (17): 6099-6107. doi:10.1021/ja910155b. (PMID) 20387841.
- ^ Koshland, D (1996). "The structural basis of negative cooperativity: receptors and enzymes". . 6 (6): 757-761. doi:10.1016/S0959-440X(96)80004-2. (PMID) 8994875.
- ^ Jencks, W. P. (1981). "On the attribution and additivity of binding energies". . 78 (7): 4046-4050. Bibcode:1981PNAS...78.4046J. doi:10.1073/pnas.78.7.4046. (PMC) 319722 $2. (PMID) 16593049.
- ^ Dobrzanska, L; Lloyd, G; Esterhuysen, C; Barbour, L (2003). "Studies into the Thermodynamic Origin of Negative Cooperativity in Ion-Pairing Molecular Recognition". Journal of the American Chemical Society. 125 (36): 10963-10970. doi:10.1021/ja030265o.
- ^ Hughes, A.; Anslyn, E (2007). "A cationic host displaying positive cooperativity in water". . 104 (16): 6538-6543. Bibcode:2007PNAS..104.6538H. doi:10.1073/pnas.0609144104. (PMC) 1871821 $2. (PMID) 17420472.
- ^ Brown, Philip; Semeniuk, Konstantin; Wang, Diandian; Monserrat, Bartomeu; Pickard, Chris J.; Grosche, F. Malte (1 Nisan 2018). "Strong coupling superconductivity in a quasiperiodic host–guest structure". Science Advances (İngilizce). 4 (4): eaao4793. doi:10.1126/sciadv.aao4793. ISSN 2375-2548. (PMC) 5898833 $2. (PMID) 29662950. 17 Kasım 2020 tarihinde kaynağından . Erişim tarihi: 18 Kasım 2020.
- ^ a b Cheng, Y.; Wang, J.; Rao, T.; He, X.; Xu, T. (2008). "Pharmaceutical applications of dendrimers: promising nanocarriers for drug discovery". . 13 (13): 1447-1471. doi:10.2741/2774.
- ^ Cheng, Y.; Xu, T. (2005). "Dendrimers as Potential Drug Carriers. Part I. Solubilization of Non-Steroidal Anti-Inflammatory Drugs in the Presence of Polyamidoamine Dendrimers". . 40 (11): 1188-1192. doi:10.1016/j.ejmech.2005.06.010.
- ^ Cheng, Y.; Xu, T; Fu, R (2005). "Polyamidoamine dendrimers used as solubility enhancers of ketoprofen". . 40 (12): 1390-1393. doi:10.1016/j.ejmech.2005.08.002.
- ^ a b Cheng, Y.; Xu, Z; Ma, M.; Xu, T. (2007). "Dendrimers as drug carriers: Applications in different routes of drug administration". . 97: 123-143. doi:10.1002/jps.21079.
- ^ D’Emanuele, A; Attwood, D (2005). "Dendrimer–drug interactions". . 57 (15): 2147-2162. doi:10.1016/j.addr.2005.09.012. (PMID) 16310283.
- ^ Malik, N.; Evagorou, E.; Duncan, R. (1999). "Dendrimer-platinate: a novel approach to cancer chemotherapy". . 10 (8): 767-776. doi:10.1097/00001813-199909000-00010. (PMID) 10573209.
- ^ de Silva, A.P.; McCaughan, B; McKinney, B.O. F.; Querol, M. (2003). "Newer optical-based molecular devices from older coordination chemistry". Dalton Transactions. 10 (10): 1902-1913. doi:10.1039/b212447p.
- ^ Anslyn, E. (2007). "Supramolecular Analytical Chemistry". Journal of Organic Chemistry. 72 (3): 687-699. doi:10.1021/jo0617971. (PMID) 17253783.
- ^ Nguyen, B.; Anslyn, E. (2006). "Indicator-displacement assays". 250 (23–24): 3118-3127. doi:10.1016/j.ccr.2006.04.009.
- ^ Yang, V.; Fu, Y.; Teng, C.; Ma, S.; Shanberge, J. (1994). "A method for the quantitation of protamine in plasma" (PDF). . 74 (4): 427-434. doi:10.1016/0049-3848(94)90158-9. (PMID) 7521974.
- ^ Eggleston, A.; Rahim, N.; Kowalczykowski, S; Ma, S.; Shanberge, J. (1996). "A method for the quantitation of protamine in plasma". . 24 (7): 1179-1186. doi:10.1093/nar/24.7.1179. (PMC) 145774 $2. (PMID) 8614617.
- ^ Atwood, J; Barbour, L; Jerga, A; Schottel, L (2002). "Guest Transport in a nonporous Organic Solid via Dynamic van der Waals Cooperativity". Science. 298 (5595): 1000-1002. Bibcode:2002Sci...298.1000A. doi:10.1126/science.1077591. (PMID) 12411698.
- ^ Kitagawa, S; Uemura, K (2005). "Dynamic porous properties of coordination polymers inspired by hydrogen bonds". Chemical Society Reviews. 34 (2): 109-119. doi:10.1039/b313997m. (PMID) 15672175.
- ^ Sozzani, P; Bracco, S; Commoti, A; Ferretti, R; Simonutti, R (2005). "Methane and Carbon Dioxide Storage in a Porous van der Waals Crystal". Angewandte Chemie. 44 (12): 1816-1820. doi:10.1002/anie.200461704. (PMID) 15662674.
- ^ Uemura, K; Kitagawa, S; Fukui, K; Saito, K (2004). "A Contrivance for a Dynamic Porous Framework: Cooperative Guest Adsorption Based on Square Grids Connected by Amide−Amide Hydrogen Bonds". J. Am. Chem. Soc. 126 (12): 3817-3828. doi:10.1021/ja039914m. (PMID) 15038736.
- ^ Dobrzanska, L; Lloyd, G; Esterhuysen, C; Barbour, L (2006). "Guest-Induced Conformational Switching in a Single Crystal". Angewandte Chemie. 45 (35): 5856-5859. doi:10.1002/anie.200602057. (PMID) 16871642.
- ^ Eric Hughes; Jason Jordan; Terry Gullion (2001). "Structural Characterization of the [Cs(p-tert-butylcalix[4]arene -H) (MeCN)] Guest–Host System by 13C-133Cs REDOR NMR". . 105 (25): 5887-5891. doi:10.1021/jp004559x.
- ^ Serkan Erdemir; Mufit Bahadir; Mustafa Yilmaz (2009). "Extraction of Carcinogenic Aromatic Amines from Aqueous Solution Using Calix[n]arene Derivatives as Carriers". . 168 (2–3): 1170-1176. doi:10.1016/j.jhazmat.2009.02.150. (PMID) 19345489.
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Konukcu konuk kimyasi Supramolekuler kimyada tam kovalent baglar disindaki kuvvetler tarafindan benzersiz yapisal iliskilerde bir arada tutulan iki veya daha fazla molekul ya da iyondan olusan kompleksleri tanimlar Kovalent olmayan baglanma yoluyla molekuler tanima ve etkilesim fikrini kapsar Kovalent olmayan baglanma proteinler gibi buyuk molekullerin 3 boyutlu yapisinin korunmasinda kritik oneme sahiptir ve buyuk molekullerin spesifik olarak ancak gecici olarak birbirine baglandigi bircok biyolojik surecte yer alir Kovalent olmayan etkilesimler kabaca daha elektrostatik veya dagitici katkilara sahip olanlara bolunebilse de yaygin olarak bahsedilen birkac kovalent olmayan etkilesim turu vardir iyonik bag hidrojen bag van der Waals kuvvetleri ve hidrofobik etkilesimler Bir cucurbituril icinde bagli bir p xylylenediammonium iceren bir konukcu konuk kompleksinin kristal yapisiBir konuk N2 bir konukcu hidrojen kapsul icinde baglanirGenel bakisKonukcu konuk kimyasi bir konukcu molekulun bir konuk molekul veya iyon ile kimyasal bir bilesik olusturdugu supramolekuler kimyanin bir dalidir Bilesigin iki bileseni kovalent olmayan kuvvetlerle en yaygin olarak hidrojen bagiyla bir arada tutulur Konucu ve konuk arasindaki baglanma genellikle ilgili iki gruba ozeldir Bu komplekslerin olusumu molekuler tanima konusunun merkezindedir Konukcu ve konukun birbirinden ayri oldugu baglanmamis durum arasinda bir denge vardir ve yapisal olarak tanimlanmis bir konukcu konuk kompleksinin bulundugu bagli durum H G HG displaystyle H G rightleftharpoons HG H konukcu G konuk HG konukcu konuk kompleksi Konukcu bileseni daha buyuk molekul olarak kabul edilebilir ve daha kucuk olan konuk molekulunu kapsar Biyolojik sistemlerde benzer konukcu ve konuk terimleri genellikle sirasiyla enzim ve substrat olarak adlandirilir Belirli islevleri ve gorevleri yerine getiren sentetik sistemler tasarlamak icin konukcu ile konuk arasindaki baglanmanin termodinamigini anlamak cok onemlidir Kimyagerler farkli baglanma etkilesimlerinin enerji alisverisine odaklaniyor ve NMR spektroskopisi UV spektroskopi ve izotermal titrasyon kalorimetrisi gibi cesitli teknikleri kullanarak bu kovalent olmayan etkilesimlerin temel kokenlerini olcmek icin bilimsel deneyler gelistirmeye calisiyorlar Baglanma sabit degerlerinin kantitatif analizi faydali termodinamik bilgiler saglar Konukcu konuk etkilesimlerinin termodinamik prensipleriKonukcu konuk kimyasinin termodinamik faydalari konukcu ve konuk molekuller arasindaki etkilesime bagli olarak genel Gibbs serbest enerjisinin daha dusuk oldugu fikrinden kaynaklanmaktadir Kimyacilar supramolekuler kimyada bulunan bu kovalent olmayan etkilesimlerin enerjisini ve termodinamik ozelliklerini kapsamli bir sekilde olcmeye calisiyorlar ve bunu yaparak supramolekuler yapi uzerinde genel bir etki yaratmak icin kullanilan bu cok sayida kucuk ve kovalent olmayan kuvvetin birlesimsel sonucu hakkinda daha fazla bilgi edinmeyi umuyorlar Bir iliski sabiti Ka displaystyle K a ominus ifadesi ile tanimlanabilir Ka HG H G HG H G G displaystyle K a ominus frac HG H G frac HG H G times Gamma Buradaki HG kompleksin dengedeki termodinamik aktivitesidir H konukcu aktivitesini ve G konugun aktivitesini temsil eder HG displaystyle HG H displaystyle H ve G displaystyle G gosterimleri konsantrasyonlara karsilik gelir ve G displaystyle Gamma aktivite katsayilarinin bir bolumudur Pratikte denge sabiti genellikle konsantrasyonlar olarak tanimlanir Ka HG H G displaystyle K a frac HG H G Bu tanim kullanildiginda aktivite katsayilarinin bolumunun sayisal bir degeri oldugu ima edilmektedir Daha sonra denge sabiti KA displaystyle K A boyutunun 1 konsantrasyona sahip oldugu ancak standart Gibbs serbest enerjisi degistigi icin bu dogru olamaz ve DG displaystyle Delta G ominus K nin logaritmasi ile orantilidir DG RTln K displaystyle Delta G ominus RT ln K Bu bariz paradoks G displaystyle Gamma boyutu konsantrasyonlar bolumunun boyutunun karsiligi olarak tanimlandiginda cozulur Bunun anlami G displaystyle Gamma nin ilgili tum deneysel kosullar altinda sabit bir degere sahip oldugunun kabul edilmesidir Bununla birlikte deneysel olarak belirlenen bir K degerine litre basina milimol veya litre basina mikromol gibi bir boyut eklemek yaygin bir uygulamadir Buyuk bir Ka displaystyle K a degeri konukcu ve konuk molekullerin konukcu konuk kompleksini olusturmak icin guclu bir sekilde etkilesime girdigini gosterir Baglanma sabit degerlerinin belirlenmesiBasit konukcu konuk kompleksi Konukcu ve konuk molekuller bir kompleks olusturmak icin birlestiginde denge su sekilde temsil edilir H G HG displaystyle H G leftrightharpoons HG ve denge sabiti K su sekilde tanimlanir K HG H G displaystyle K frac HG H G Burada X X kimyasal turunun konsantrasyonunu gosterir tum aktivite katsayilarinin sayisal degerlerinin 1 oldugu varsayilir Herhangi bir veri noktasindaki kutle dengesi denklemleri TH H K H G displaystyle T H H K H G TG G K H G displaystyle T G G K H G TG displaystyle T G ve TH displaystyle T H konukcu ve konugun toplam konsantrasyonlarini temsil ettigi yerlerde ornegin G de tek bir ikinci dereceden denkleme indirgenebilir ve boylece herhangi bir K degeri icin analitik olarak cozulebilir H ve HG konsantrasyonlari daha sonra turetilebilir H TH TG G displaystyle H T H T G G HG K H G displaystyle HG K H G Hesaplamadaki bir sonraki adim gozlemlenen Xiobs displaystyle X i obs ifadesine karsilik gelen miktarin Xicalc displaystyle X i calc degerini hesaplamaktir Daha sonra kareler toplami U ve tum veri noktalarinda np su sekilde tanimlanabilir U i 1 np Xiobs Xicalc 2 displaystyle U sum i 1 np X i obs X i calc 2 ve bu stabilite sabiti degeri K ve HG turunun kimyasal kaymasi nmr verileri veya molar emilimi uv vis verileri gibi bir parametre ile ilgili olarak en aza indirilebilir Kucultme dahili SOLVER yardimci programi kullanilarak EXCEL gibi bir elektronik tablo uygulamasinda gerceklestirilebilir Bu prosedur yalnizca 1 1 eklentisinin olusan tek karmasik tur oldugu kesin oldugunda kullanilmalidir Bu iddianin gecerliligine iliskin basit bir kontrol kalintilarin Xiobs Xicalc displaystyle X i obs X i calc rastgele bir dagilim gostermesi gerektigidir aksi takdirde ikinci bir turun olusumu dikkate alinmalidir Nukleer manyetik rezonans NMR verileri Nukleer manyetik rezonans NMR spektrumlari ile bir reaktif molekulunde bulunan belirli bir atomdan ve bu reaktifin bir veya daha fazla kompleksinden kaynaklanan gozlenen kimyasal kayma degeri d bu kimyasal turlerin tum kaymalarinin konsantrasyon agirlikli ortalamasi olacaktir NMR zaman olceginde kimyasal degisimin hizli oldugu varsayilir Mol fraksiyonlari terimleri d xidi displaystyle bar delta sum x i delta i di displaystyle delta i cekirdegi iceren i nci kimyasal turlerin kimyasal kaymasidir ve xi displaystyle x i bu turlerin konsantrasyonu mol fraksiyonudur xi ci jcj displaystyle x i frac c i sum j c j c bir konsantrasyon mol dm 3 tur Bu ifade Beer in yasasi ile ayni matematiksel forma sahiptir Kimyasal kayma degerleri emmenin birden fazla dalga boyunda olculebilmesine benzer bir sekilde birden fazla cekirdek icin elde edilebilir Bu baglamda kullanilabilecek tipik izotoplar 1H 13C ve 31P dir 1H kimyasal kayma degerlerini olcerken doteryumlanmis bir cozucu kullanmak olagandir Absorbans verileri Bir konukcu konuk sistemi icin tipik morotesi gorunur spektrumlar Beer Lambert yasasina gore her turun absorbansinin o turun konsantrasyonu ile orantili oldugu varsayilmaktadir Al ℓ i 1Nei lci displaystyle A lambda ell sum i 1 N varepsilon i lambda c i Burada l bir dalga boyudur ℓ displaystyle ell N bilesiklerinin kromoforlar cozeltisini iceren kuvetin optik yol uzunlugudur ei l displaystyle varepsilon i lambda l dalga boyundaki i inci kimyasal turun molar absorbansidir yok olma katsayisi olarak da bilinir ci ise konsantrasyonudur Konsantrasyonlar yukaridaki gibi hesaplandiginda ve cesitli konukcu konuk konsantrasyonlarina sahip numuneler icin absorbans olculdugunde Beer Lambert yasasi belirli bir dalga boyunda o dalga boyundaki bilinmeyen sonme katsayisi degerleri icin dogrusal en kucuk kareler islemiyle cozulebilen bir dizi denklem saglar Floresans verileri Bu tur verilerin islenmesi absorbans verilerinin islenmesine benzer Aslinda floresan yogunlugu ve tur konsantrasyonlari arasindaki iliskiyi tanimlayan denklem cok benzerdir Il i 1Nfi lci displaystyle I lambda sum i 1 N varphi i lambda c i Burada fi l displaystyle varphi i lambda birim konsantrasyondaki i inci turun floresan yogunlugudur Kalorimetre Konuku iceren cozeltiye bir miktar konukcu cozeltisi eklendiginde ortaya cikan isi her reaksiyondan gelen katkilarin toplamidir Qj i 1NDHi dni j displaystyle Q j sum i 1 N Delta H i ominus times delta n i j Burada Qj displaystyle Q j j veri noktasinda olculen isi degisim degeridir tum yabanci isi katkilari icin duzeltildi DHi displaystyle Delta H i ominus i nci reaksiyon urununun 1 molu olustugunda emilen veya yayilan isi miktaridir dni j displaystyle delta n i j o urunun o veri noktasindaki mol sayisindaki gercek degisimdir dn displaystyle delta n kutle denge denklemlerinin verilen denge sabitlerinin degerleri ile cozulmesiyle hesaplanir Denge sabit degerleri biliniyorsa standart entalpi degisimi dogrusal en kucuk kareler islemiyle hesaplanabilir aksi takdirde dogrusal olmayan bir veri uydurma yontemi kullanilmalidir Izotermal titrasyon kalorimetrisi hem bir denge sabitinin hem de karsilik gelen standart reaksiyon entalpisinin degerlerini belirlemek icin yaygin olarak kullanilir ITC aletlerinin ureticileri bu miktarlarin deneysel veri degerlerinden elde edilebilecegi bazi yazilimlari tedarik etmektedir Genel komplekslesme reaksiyonu Bir konukcu H ve bir konuk G yi iceren her denge icin pH qG HpGq displaystyle pH qG leftrightharpoons H p G q denge sabiti bpq displaystyle beta pq su sekilde tanimlanir bpq HpGq H p G q displaystyle beta pq frac H p G q H p G q Serbest konsantrasyonlarin H displaystyle H ve G displaystyle G degerleri kutle dengesi denklemlerinin kararlilik sabitleri icin bilinen veya tahmin edilen degerlerle cozulmesiyle elde edilir TH H pbpq H p G q displaystyle T H H sum p beta pq H p G q TG G qbpq H p G q displaystyle T G G sum q beta pq H p G q Daha sonra her bir kompleks turunun konsantrasyonlari da HpGq bpq H p G q displaystyle H p G q beta pq H p G q olarak hesaplanabilir Bir turun konsantrasyonu ile olculen miktar arasindaki iliski yukaridaki her bolumde belirtildigi gibi olcum teknigine ozgudur Bu iliskiyi kullanarak molar absorptivite veya belirli kimyasal kaymalar gibi parametrelerin seti stabilite sabiti degerleri ve ozelliklerin degerleri dogrusal olmayan en kucuk kareler rafine edilebilir Standart entalpi ve entropi degisim degerlerinin belirlenmesiIlk olarak bir cozumun tek kompleks HG ile dengede olan belirli miktarlarda bir konukcu H ve bir konuk G icerdigi sistem dusunulur H G HG displaystyle H G leftrightharpoons HG Sonra dengede bir konukcu ve konuk karisimina az miktarda konuk eklendigi varsayilir Bu durumda yeni bir denge kurulacak ve bir miktar Q isisi gelisecektir Bu miktar aracsal faktorler icin olculdugunde ve duzeltildiginde cozelti icinde mevcut olan kompleks HG miktarindaki degisiklikle ilgilidir Qcorrected DH dn displaystyle Q corrected Delta H ominus times delta n DH standart olusum entalpisidir yani kompleksin 1 mol olusumu icin entalpidir HG ve dn displaystyle delta n cozeltideki HG turlerinin mol sayisindaki degisimdir Denge sabitinin degeri K displaystyle K biliniyorsa dn displaystyle delta n kutle dengesi denklemlerinin toplamadan once ve sonra cozulmesiyle hesaplanabilir Daha sonra DH degeri bir dizi Q deneysel degeri ile uydurulan dogrusal en kucuk kareler yontemi kullanilarak elde edilebilir K nin degeri bilinmiyorsa DH displaystyle Delta H ominus ve K displaystyle K olmak uzere iki parametreyi elde etmek icin dogrusal olmayan en kucuk kareler ayrintilandirmasi yapilmalidir Veriler bir izotermal titrasyon kalorimetresi kullanilarak elde edildiginde hesaplamalar icin gerekli olan yazilim cihaz ureticisi tarafindan saglanir Not Standart entalpi degisimini hesaplamak icin van t Hoff denklemi artik kullanilmamaktadir cunku bu yontem kullanilarak elde edilen deger buyuk olasilikla asiri hataya maruz kalacaktir Genel olarak m kompleksleri olustugunda k inci titrasyon noktasinda gelistirilen isi bir reaksiyon urununun konsantrasyonundaki bir degisiklikten kaynaklanan katkilarin toplamidir Qkcorrected i 1 mDHi dni k displaystyle Q k corrected sum i 1 m Delta H i ominus times delta n i k Her reaksiyon urununun olusumu icin standart bir entalpi degisimi ve bir denge sabiti belirlenecek 2m parametresi vardir ITC cihaz ureticileri birden cok parametre degerinin hesaplanabilecegi birkac ozel yazilim urunu tedarik etmektedir HypDH gibi genel durum icin bilgisayar programlari Afinimetre ITC de mevcuttur Her bir standart entalpi degisiminin ve denge sabitinin degerleri belirlendiginde karsilik gelen standart entropi degisiminin degeri su ifadeden turetilebilir DSi DHi RTln KiT displaystyle Delta S i ominus frac Delta H i ominus RT ln K i T T verilen sicakliginda Deneysel tekniklerNukleer manyetik rezonans Nukleer manyetik rezonans NMR analitik kimyadaki en guclu spektroskopik tekniklerden biridir Agregalar iyon cifti veya kapsullenmis sistemler seklinde var olan cesitli komplekslerin yapilarini aydinlatmak icin konukcu konuk kompleksleri calismalari icin onemli bir aractir Adindan da anlasilacagi gibi NMR molekullerdeki farkli cekirdekleri en yaygin olarak proton kimyasal kaymalarini olcerek tanimlar Iki molekulun baglanma aktivitesi elektronik ortamlarinda onemli bir degisiklige neden olur Bu NMR spektrumundaki sinyallerde bir kaymaya yol acar ve bu temel ilkeden konukcu konuk kimyasi fenomenini incelemek icin kullanilir Konukcu konuk baglanmasinin itici gucleri hidrojen bagi ve pi pi etkilesimi gibi molekuller arasindaki cesitli ikincil etkilesimlerdir Boylelikle NMR bir konukcu konuk kompleksinde bu etkilesimlerin varligini tespit etmek icin onemli bir teknik olarak hizmet eder Ilac verme uygulamalari sadece basitlik icin gosterilen son gruplar ve yaygin ilaclar icin kullanilan dendrimerler Ilac ve dendrimer arasindaki baglanmanin dogasi ilaclarin vucutta etkili bir sekilde salinmasi icin onemlidir Onceki NMR calismalari farkli konuklarin konuculara baglanmasi hakkinda yararli bilgiler vermistir Fox vd piridin molekulleri ile poliamidoamin PAMAM dendrimeri arasindaki hidrojen bagi etkilesimlerini amin ve amid gruplarinin kimyasal kaymasina gore hesapladi Benzer bir calismada Xu ve vd titre edilmis karboksilat bazli G4 PAMAM dendrimer konukcu cesitli amin bazli ilaclar konuklar ile ve dendrimerin kimyasal kaymalarini izledi 2D NOESY NMR teknikleriyle baglantili olarak ilaclarin dendrimerler uzerindeki konumunu ve islevselligin ilaclarin baglanma afinitesi uzerindeki etkisini tam olarak tespit edebildiler Katyonik ilac molekullerinin anyonik dendrimerlerin yuzeyine elektrostatik etkilesimlerle baglandigini oysa anyonik bir ilacin dendrimerlerin hem cekirdeginde hem de yuzeyinde lokalize oldugunu ve bu etkilesimlerin gucunun molekullerin pKa degerlerine bagli oldugunu gosteren kesin kanitlar buldular Farkli bir calismada Sun ve vd cucurbituril ile rutenyum trisbipiridil viologen molekullerinin konukcu konuk kimyasini inceledi Viologen uzerindeki piridin protonlarinin kimyasal degisimlerini izlerken 1 1 komplekslerinin baglanma modlarinin farkli cucurbituril molekulleri icin tamamen farkli oldugunu bulmuslardir Konukcu ve konuk arasindaki baglanmayi analiz ederken akilda tutulmasi gereken onemli bir faktor baglanma olayinin zamanina kiyasla veri toplama icin gecen zamandir Cogu durumda baglanma olaylari veri edinme zaman olceginden cok daha hizlidir bu durumda cikti ayri molekuller ve kompleks icin ortalama bir sinyaldir NMR zaman olcegi milisaniye mertebesinde olup bazi durumlarda baglanma reaksiyonunun hizli oldugu durumlarda teknigin dogrulugunu sinirlar Ultraviyole gorunur spektroskopi Viologen ve cucurbituril ler arasinda baglanma Ultraviyole ile gorulebilir spektroskopi cesitli molekullerin baglanma aktivitesini arastirmanin en eski ve en hizli yontemlerinden biridir UV isiginin absorpsiyonu pikosaniye zaman olceginde gerceklesir bu nedenle turlerden gelen bireysel sinyaller gozlemlenebilir Ayni zamanda absorpsiyonun yogunlugu turlerin konsantrasyonu ile dogrudan iliskilidir bu da iliski sabitinin kolay hesaplanmasini saglar En yaygin olarak ya konukcu ya da konuk UV isigina karsi saydam iken diger molekul UV duyarlidir UV ye duyarli molekullerin konsantrasyonundaki degisiklik boylece izlenir ve birlesme sabitinin dogrudan hesaplanabildigi Benesi Hildebrand yontemi kullanilarak duz bir cizgiye yerlestirilir Benesi Hilderbrand yontemi konukcu ve konuk arasinda 1 1 lik bir stoikiometri varsaydigindan komplekslerin stokiyometrisi hakkinda ek bilgi de elde edilir Veriler ancak kompleks olusumu da benzer bir 1 1 stokiyometrisini takip ederse duz bir cizgi verecektir Benzer hesaplamanin yakin tarihli bir ornegi Sun vd tarafindan yapildi burada rutenyum trisbipiridil viologen molekullerini kabakturillerle titre ettiler ve kabakgil molekullerinin goreceli absorbansini belirli bir dalga boyundaki toplam konsantrasyonunun bir fonksiyonu olarak cizdiler Veriler 1 2 105M 1 displaystyle 1 2 10 5 M 1 nin baglanma sabitine sahip bir 1 1 baglama modeline guzel bir sekilde uymustur Bir uzanti olarak konukcu ve konuk arasindaki baglanma olaylarinin kinetigini anlamak icin veriler farkli stokiyometrilere sigdirilabilir Bu sonuc diger parametrelerle birlikte cesitli konuk imidazoller ve amino asit metil esterleri ile baryum iceren kron eter koprulu kiral heterotrinukleer salen Zn II kompleksi BaZn2L ClO4 2 displaystyle BaZn 2 L ClO 4 2 arasindaki komplekslesme reaksiyonunun sirasini elde etmek icin geleneksel Benesi Hilderbrand grafigini biraz degistirmek icin kullanildi 368 nm de pi den pi ye gecis bandinin absorbansindaki degisiklikleri izlerken degisen miktarlarda imidazoller ve metil esterler ile sabit bir cinko kompleksi konsantrasyonu titre ettiler Veriler komplekste konuk konukcu oraninin 2 oldugu bir modele uyar Bu deneyleri van t Hoff denklemini kullanarak cesitli termodinamik parametreleri hesaplamalarini saglayan cesitli sicakliklarda gerceklestirdiler Izotermal titrasyon kalorimetrisi Spektroskopik teknikler baglanma sabiti Ka displaystyle K a ve Gibbs serbest enerjisi DG displaystyle Delta G hakkinda bilgi verir DH displaystyle Delta H ve DS displaystyle Delta S gibi termodinamik parametrelerin tam setini elde etmek icin van t Hoff denklemini kullanan bir van t Hoff analizi gerekli olacaktir Bununla birlikte kalorimetrik tekniklerdeki son gelismeler tek bir deneyde Ka displaystyle K a ve DH displaystyle Delta H nin olculmesine izin verir ve boylece denklem kullanilarak tum termodinamik parametrelerin belirlenmesini saglar DG DH TDS displaystyle Delta G Delta H T Delta S Deneyin izotermal kosullar altinda yapilmasi sarttir bu nedenle dizotermal kalorimetri adi verilir Prosedur konvansiyonel bir titrasyon prosedurune benzer olup burada konukcuya sirayla konuka eklenir ve emilen veya gelisen isi bos bir solusyonla karsilastirildiginda olculur Aciga cikan toplam isi Q denklem tarafindan Ka displaystyle K a ve DH0 displaystyle Delta H 0 iliskilendirme sabitine karsilik gelir Q VDH0 H G displaystyle Q V Delta H 0 H G Herhangi biri su sekilde basitlestirilebilir Q VDH0Ka H0 G 1 Ka G displaystyle Q frac V Delta H 0 K a H 0 G 1 K a G olmak uzere H0 displaystyle H 0 Konukcunun ilk molar konsantrasyonu G displaystyle G Konukun molar konsantrasyonu V displaystyle V Vessel hacmi Yukaridaki denklem dogrusal olmayan regresyon analizi ile cozulerek Ka displaystyle K a ve DG displaystyle Delta G nin degeri ve ardindan bu ozel reaksiyon icin DH displaystyle Delta H ve DS displaystyle Delta S nin degeri elde edilebilir Izotermal titrasyon kalorimetrisinin diger yaygin olarak kullanilan tekniklere gore avantajlari tum termodinamik parametreleri vermenin yani sira daha genel olmasi ve cok cesitli molekuller icin uygun olmasidir Isi sinyali baglanma reaksiyonlarinin evrensel bir ozelligi oldugundan baglanma surecini izlemek icin kromoforlu veya UV ile gorunur fonksiyonel gruplara sahip bilesiklere sahip olmak gerekli degildir Ayni zamanda sinyal gurultu orani oldukca uygundur bu da cok seyreltik kosullar altinda bile baglanma sabitlerinin daha dogru belirlenmesine izin verir Bu teknigin kullaniminin yeni bir ornegi Escherichia coli yi cevreleyen protein zarinin cesitli zar mimetik ortamlarinda ilaclarda kullanilan lipofilik katyonlara baglanma afinitesinin incelenmesi icindi Yukaridaki calismanin motivasyonu bu zarlarin bakterileri antibakteriyel etkilere sahip olan kuaterner amonyum katyonuna dayanan cogu bilesige direncli hale getirmesiydi Bu nedenle baglanma fenomeninin anlasilmasi E coli icin etkili antibiyotiklerin tasarlanmasini saglayacaktir Arastirmacilar baglanma reaksiyonunun tamamlanmasina izin vermek icin protein uzerinde ligandin buyuk bir fazlasini muhafaza ettiler Arastirmacilar yukaridaki denklemleri kullanarak farkli ortamlardaki her ilac icin Ka displaystyle K a DG displaystyle Delta G DH displaystyle Delta H ve DS displaystyle Delta S yi hesaplamaya devam ettiler Veriler ilacin zara baglanma stokiyometrisinin 1 1 mikromolar degerinde Ka displaystyle K a oldugunu gosterdi Negatif DG displaystyle Delta G DH displaystyle Delta H ve DS displaystyle Delta S degerleri prosesin her ilac icin 8 12 kcal mol degerinde entalpi suruldugunu gosterdi UygulamalarRaman spektroskopisi Raman spektroskopisi uzerine monokromatik isik geldiginde bir Raman sacilma etkisi sergileyen molekullerin calismasinda kullanilan spektroskopik bir tekniktir Bir Raman sinyali almanin temel sarti olay isiginin kimyasal turlerde temel durumundan sanal enerji durumuna elektronik bir gecise neden olmasidir bu da temel duruma dondugunde bir foton yayar Emilen ve yayilan foton arasindaki enerji farki elektronik ortamina bagli olarak her kimyasal tur icin benzersizdir Bu nedenle molekuller arasindaki baglanma neredeyse her zaman elektronik ortamlarinda bir degisiklikle sonuclandigindan teknik cesitli baglanma olaylarinin incelenmesi icin onemli bir arac olarak hizmet eder Bununla birlikte Raman spektroskopisini benzersiz bir teknik yapan sey yalnizca molekulun polarizasyonundaki bir degisikligin eslik ettigi gecislerin Raman aktif olmasidir Raman spektrumlarindan turetilen yapisal bilgiler kompleksin elektronik konfigurasyonu hakkinda bireysel konukcu ve konuk molekullere kiyasla cok spesifik bilgiler verir Rezonans Raman sacilmasinin sematik gosterimi Lambda lazerin olay dalga boyudur Cozelti fazli Raman spektroskopisi genellikle zayif bir sacilma enine kesiti ile sonuclanir Bu nedenle yuzeyde gelistirilmis Raman spektroskopisi ve Rezonans Raman spektroskopisi gibi Raman sinyallerini gelistirmek icin son gelismeler saglanmistir Bu tur teknikler analit reseptor baglanma olaylarinin nicellestirilmesi icin ek bir amaca hizmet ederek gercekte cozumlerde yer aldiklari konukcu konuk komplekslesmesi olgusunun daha ayrintili bir resmini verir Yakin tarihli bir bulusta Flood vd Raman spektroskopisi ve SERS kullanilarak tetrathiafulvalene TTF ve cyclobis in paraquat p phenylene baglanma gucunu belirledi Bu alandaki onceki calisma iliski kuvvetlerinin nicel olcumlerinden ziyade sonucta ortaya cikan kompleksin baglanmasi ve yapisi hakkinda bilgi saglamayi amaclamistir Arastirmacilar 1 mM kadar dusuk konsantrasyonlara sahip cozeltilerden tespit edilebilir sinyaller alabilmek icin Rezonans Raman spektroskopisi kullanmak zorunda kaldilar Ozellikle Raman bantlarinin yogunlugunu foto uyarilmis durumdaki kompleksin geometrisiyle iliskilendirdiler Ultraviyole gorunur spektroskopiye dayali titrasyona benzer sekilde baglanma sabitini Raman titrasyonu ile hesapladilar ve baglanma egrilerini 1 1 modellere uydurarak 5 7 0 6 kcal mol DG displaystyle Delta G degerini verdiler Calisma simdi cozumlerde yuk transfer komplekslerini iceren benzer calismalar icin bir temel sagliyor Cooperativity Bir ligandin birden fazla baglanma yeri olan bir reseptore baglandigi zaman ligand gelen ligandlar icin afinitede bir azalmaya veya artisa neden olarak tanimlanir Sonraki ligandlarin baglanmasinda bir artis varsa pozitif cooperativity olarak kabul edilir Baglanmada bir azalma gozlenirse bu negatif cooperativity dir Pozitif ve negatif cooperativity ornekleri sirasiyla hemoglobin ve aspartat reseptorudur Genel Konukcu Konuk Baglantisi 1 Konuk A baglayici 2 Konuk B baglayici 3 Pozitif Cooperativity Konuk A B baglayici 4 Negatif Cooperativity Konuk A B baglayici Son yillarda pozitif veya negatif cooperativity i ayirt eden matematiksel parametreleri tanimlamak icin cooperativity in termodinamik ozellikleri incelenmistir Geleneksel Gibbs serbest enerji denklemi su sekildedir DG DH TDS displaystyle Delta G Delta H T Delta S Bununla birlikte bir konukcu konuk sistemindeki cooperativity i olcmek icin baglayici enerjinin dikkate alinmasi gerekir Sagdaki sematik A nin baglanmasini B nin baglanmasini A B nin pozitif cooperativity bagini ve son olarak A B nin negatif cooperativity li bagini gostermektedir Bu nedenle Gibbs serbest enerji denkleminin alternatif bir bicimi soyle olacaktir DGS DGA DGB DGAB displaystyle Delta G S circ Delta G A circ Delta G B circ Delta G AB circ DHS DHA DHB DHAB displaystyle Delta H S circ Delta H A circ Delta H B circ Delta H AB circ TDGS TDHA TDHB TDSAB displaystyle T Delta G S circ T Delta H A circ T Delta H B circ T Delta S AB circ olmak uzere DGA displaystyle Delta G A circ A baglanmasinin serbest enerjisi DGB displaystyle Delta G B circ B baglanmasinin serbest enerjisi DGS displaystyle Delta G S circ A ve B bagli icin serbest baglanma enerjisi DGAB displaystyle Delta G AB circ Baglanmanin serbest enerjilerinin toplami DGS displaystyle Delta G S circ nin DGA displaystyle Delta G A circ ve DGB displaystyle Delta G B circ toplamindan daha fazla olmasi durumunda pozitif olarak cooperativity yaptigi dusunulmektedir DGS displaystyle Delta G S circ daha azsa o zaman negatif cooperativity dir Konukcu konuk kimyasi reseptor lingu ve etkilesimleriyle sinirli degildir Iyon eslestirme sistemlerinde de gosterilmistir Son yillarda bu tur etkilesimler sentetik organometalik konukcular ve organik konuk molekuller kullanilarak sulu bir ortamda incelenmistir Ornegin bakir iceren bir poli katyonik reseptor tetrakarboksilatlar trikarbokat aspartat ve asetat gibi molekullerle koordine edilir Bu calisma entropinin entropinin negatif cooperativity ne yol acan sistemin baglanma enerjisini belirledigini gostermektedir Entropideki buyuk degisiklik ligand ve reseptoru cevreleyen cozucu molekullerin yer degistirmesinden kaynaklanir Birden fazla asetat reseptore baglandiginda cevreye bir tetrakarboksilattan daha fazla su molekulu salar Bu sistemin olumsuz cooperativity yaptigini ima eden serbest enerjide bir azalmaya yol acti Guanidinyum ve Cu II ve polikarboksilat misafirleri kullanan benzer bir calismada pozitif cooperativity nin buyuk olcude entalpi tarafindan belirlendigi gosterilmistir Termodinamik calismalara ek olarak konukcu konuk kimyasinin biyolojik uygulamalari da vardir Superiletkenlik Dusuk sicakliklarda ve yuksek basinclarda bizmutun bir konukcu konuk yapisi sergiledigi bulunmustur Bu sasirtici bir sekilde guclu bir baglanti super iletkenligine yol acar Biyolojik uygulama Dendrimer Turleri 1 Kapsulleme Etkilesimi 2 Konjuge Etkilesim Ilac dagitim sistemlerindeki dendrimerler cesitli konukcu konuk etkilesimlerine bir ornektir Konukcu ve konuk sirasiyla dendrimer ve ilac arasindaki etkilesim hidrofobik veya kovalent olabilir Konukcu ve konuk arasindaki hidrofobik etkilesim kapsullenmis olarak kabul edilirken kovalent etkilesimlerin konjuge oldugu kabul edilir Tipta dendrimerlerin kullaniminin ilacin cozunurlugunu ve biyoyararlanimini artirarak ilac dagitimini iyilestirdigi gosterilmistir Bir arada dendrimerler hem hucresel alimi hem de hedefleme yetenegini artirabilir ve ilac direncini azaltabilir Cesitli NSAID lerin cozunurlugu PAMAM dendrimerleri icinde kapsullendiginde artar Bu calisma NSAID cozunurlugunun artmasinin PAMAM daki yuzey amin gruplari ile NSAID lerde bulunan karboksil gruplari arasindaki elektrostatik etkilesimlerden kaynaklandigini gostermektedir Cozunurlukteki artisa katkida bulunanlar ilaclardaki aromatik gruplar ile dendrimerin ic bosluklari arasindaki hidrofobik etkilesimlerdir Bir ilac bir dendrimer icinde kapsullendiginde spesifik olmama ve toksisite dahil olmak uzere fiziksel ve fizyolojik ozellikleri degismeden kalir Bununla birlikte dendrimer ve ilac kovalent olarak birbirine baglandiginda spesifik doku hedeflemesi ve kontrollu salim oranlari icin kullanilabilir Dendrimer yuzeyler uzerinde birden fazla ilacin kovalent konjugasyonu bir cozunmezlik sorunu olusturabilir Bu prensip ayni zamanda kanser tedavisi uygulamasi icin de calisilmaktadir Cesitli gruplar asagidakiler gibi kanser onleyici ilaclari kapsulledi Camptothecin Methotrexate ve Doxorubicin Bu arastirmalardan elde edilen sonuclar dendrimerlerin suda cozunurlugunu artirdigini salim hizini yavaslattigini ve muhtemelen ilaclarin sitotoksisitesini kontrol ettigini gostermistir Cisplatin yukarida listelenenlerle ayni farmakolojik sonuclara yol acan PAMAM dendrimerlerine konjuge edilmistir ancak konjugasyon ayrica intravenoz uygulamada kati tumorlerde sisplatin birikmesine neden olmustur Algilama Geleneksel olarak kimyasal algilamaya bir baglayici yoluyla bir reseptore kovalent olarak bagli bir gosterge iceren bir sistemle yaklasilmistir Analit baglandiginda gosterge rengi veya floresanlari degistirir Bu teknik gosterge ayirici alici ISR yaklasimi olarak adlandirilir ISR nin tersine Gosterge Yer Degistirme Testi IDA bir reseptor gosterge ve bir analit arasinda kovalent olmayan bir etkilesim kullanir ISR ye benzer sekilde IDA da kolorimetrik C IDA ve floresans F IDA gostergeleri kullanir Bir IDA tahlilinde bir reseptor gosterge ile inkube edilir Analit karisima eklendiginde gosterge ortama salinir Gosterge serbest birakildiginda rengi veya floresanlari degistirir Kemosensor Turleri 1 Gosterge ayirici reseptor ISR 2 Gosterge Yer Degistirme Testi IDA IDA geleneksel ISR kimyasal algilama yaklasimina gore cesitli avantajlar sunar Ilk olarak gostergenin reseptore kovalent olarak baglanmasini gerektirmez Ikincisi kovalent bag olmadigi icin ayni reseptorle cesitli gostergeler kullanilabilir Son olarak analizin kullanilabilecegi ortam cesitlidir Gosterge Yer Degistirme Testi Gostergeleri 1 Azure A 2 tiyazol turuncu C IDA gibi kimyasal algilama tekniklerinin biyolojik etkileri vardir Ornegin protamin herapinin antikoagulan aktivitesine karsi hareket eden kardiyopulmoner cerrahiden sonra rutin olarak uygulanan bir pihtilastiricidir Plazma orneklerindeki protamini olcmek icin kolorimetrik yer degistirme deneyi kullanilir Azure A boya bagli olmadiginda mavidir ancak herapine baglandiginda mor renk gosterir Azure A ve heparin arasindaki baglanma zayif ve tersine cevrilebilir Bu protaminin Azure A nin yerini almasina izin verir Boya serbest birakildiginda mor bir renk gosterir Boyanin yer degistirme derecesi plazmadaki protamin miktari ile orantilidir F IDA Kwalczykowski ve meslektaslari tarafindan E coli deki helikaz aktivitelerini izlemek icin kullanilmistir Bu calismada gosterge olarak tiyazol turuncu kullandilar Helikaz ssDNA yapmak icin dsDNA yi cozer Tiyazol turuncunun floresan yogunlugu ssDNA dan daha buyuk bir dsDNA afinitesine sahiptir ve fluoresans yogunlugu bagli olmadigindan daha dsDNA ya baglandiginda artar Konformasyonel anahtarlama Kristal bir kati geleneksel olarak atomik bilesenlerinin hareketlerinin titresim dengesiyle sinirli oldugu statik bir varlik olarak gorulmustur Grafitin elmasa donusumunden goruldugu gibi fiziksel veya kimyasal basinc altinda katidan katiya donusum gerceklesebilir Yakin zamanda bir kristal duzenlemesinden digerine donusumun isbirligine dayali bir sekilde gerceklestigi one surulmustur Bu calismalarin cogu organik veya metal organik bir cerceveyi incelemeye odaklanmistir Makromolekuler kristalin donusum calismalarina ek olarak organik cozuculer varliginda konformasyonlarini degistirebilen tek kristal molekuller uzerinde de calismalar vardir Bir organometalik kompleksin cozucu buharlarina maruz kalip kalmadigina bagli olarak cesitli yonelimlere donustugu gosterilmistir Cevresel uygulamalar Tehlikeli maddeleri ortamdan uzaklastirmak icin konukcu konuk sistemleri kullanilmistir Cesitli kimyasal konuklari yakalamak icin farkli boyutlarda ve farkli sekillerde yapilabilirler Uygulama p tert butycalixarene nin sezyum iyonunu yakalayabilmesidir Sezyum 137 radyoaktiftir ve onu nukleer atiklardan verimli bir sekilde uzaklastirma ihtiyaci vardir Konukcu konuk kimyasi kanserojen aromatik aminleri ve bunlarin N nitroso turevlerini sudan uzaklastirmak icin de kullanilmistir Bu atik malzemeler bircok endustriyel islemde kullanilir ve pestisitler ilaclar ve kozmetikler gibi cesitli urunlerde bulunur Kaynakca Steed Jonathan W Atwood Jerry L 2009 Supramolecular Chemistry 2nd bas Wiley s 1002 ISBN 978 0 470 51234 0 Lodish H Berk A Kaiser C 2008 Molecular Cell Biology ISBN 978 0 7167 7601 7 Freeman Wade A 1984 Structures of the p xylylenediammonium chloride and calcium hydrogensulfate adducts of the cavitand cucurbituril C36H36N24O12 40 382 387 doi 10 1107 S0108768184002354 Valdes Carlos Toledo Leticia M Spitz Urs Rebek Julius 1996 Structure and Selectivity of a Small Dimeric Encapsulating Assembly Chem Eur J 2 ss 989 991 doi 10 1002 chem 19960020814 a b c d e Anslyn Eric V Dougherty Dennis A 2005 Modern Physical Organic Chemistry MacMillan ISBN 978 1 891389 31 3 Pineiro A Banquy X Perez Casas S Tovar E Garcia A Villa A Amigo A Mark A E Costas M 2007 On the Characterization of Host Guest Complexes Surface Tension Calorimetry and Molecular Dynamics of Cyclodextrins with a Non ionic Surfactant Journal of Physical Chemistry B 111 17 4383 92 doi 10 1021 jp0688815 PMID 17428087 Hu J Cheng Y Wu Q Zhao L Xu T 2009 Host Guest Chemistry of Dendrimer Drug Complexes 2 Effects of Molecular Properties of Guests and Surface Functionalities of Dendrimers 113 31 10650 10659 doi 10 1021 jp9047055 Santo M Fox M 1999 Hydrogen bonding interactions between Starburst dendrimers and several molecules of biological interest 12 4 293 307 doi 10 1002 SICI 1099 1395 199904 12 4 lt 293 AID POC88 gt 3 0 CO 2 Q a b c Sun S Zhang R Andersson S Pan J Zou D Akermark Bjorn Sun Licheng 2007 Host Guest Chemistry and Light Driven Molecular Lock of Ru bpy 3 Viologen with Cucurbit 7 8 urils 111 47 13357 13363 doi 10 1021 jp074582j Zhu Ruan Wen Juan Chen Jia Mei Zhang Ying Hui Zhu Zhi Ang 1989 Spectroscopy NMR and DFT studies on molecular recognition of crown ether bridged chiral heterotrinuclear salen Zn II complex 62 4 5 886 895 Bibcode 2005AcSpA 62 886G doi 10 1016 j saa 2005 03 021 Brandts Williston S Brandts J Lin L 1989 Rapid measurements of Binding Constants and Heats of binding Using a New Titration Calorimeter 179 131 137 doi 10 1016 0003 2697 89 90213 3 Sikora C Turner R 2005 Investigation of Ligand Binding to the Multidrug Resistance Protein EmrE by Isothermal Titration Calorimetry 88 1 475 482 Bibcode 2005BpJ 88 475S doi 10 1529 biophysj 104 049247 PMC 1305024 2 PMID 15501941 Witlicki Edward H Hansen Stinne W Christensen Martin Hansen Thomas S Nygaard Sune D Jeppesen Jan O Wong Eric W Jensen Lasse Flood Amar H 2009 Determination of Binding Strengths of a Host Guest Complex Using Resonance Raman Scattering Journal of Physical Chemistry A 113 34 9450 9457 Bibcode 2009JPCA 113 9450W doi 10 1021 jp905202x PMID 19645430 Witlicki Edward H Andersen Sissel S Hansen Stinne W Jeppesen Jan O Wong Eric W Jensen Lasse Flood Amar H 2010 Turning on Resonant SERRS Using the Chromophore Plasmon Coupling Created by Host Guest Complexation at a Plasmonic Nanoarray Journal of the American Chemical Society 132 17 6099 6107 doi 10 1021 ja910155b PMID 20387841 Koshland D 1996 The structural basis of negative cooperativity receptors and enzymes 6 6 757 761 doi 10 1016 S0959 440X 96 80004 2 PMID 8994875 Jencks W P 1981 On the attribution and additivity of binding energies 78 7 4046 4050 Bibcode 1981PNAS 78 4046J doi 10 1073 pnas 78 7 4046 PMC 319722 2 PMID 16593049 Dobrzanska L Lloyd G Esterhuysen C Barbour L 2003 Studies into the Thermodynamic Origin of Negative Cooperativity in Ion Pairing Molecular Recognition Journal of the American Chemical Society 125 36 10963 10970 doi 10 1021 ja030265o Hughes A Anslyn E 2007 A cationic host displaying positive cooperativity in water 104 16 6538 6543 Bibcode 2007PNAS 104 6538H doi 10 1073 pnas 0609144104 PMC 1871821 2 PMID 17420472 Brown Philip Semeniuk Konstantin Wang Diandian Monserrat Bartomeu Pickard Chris J Grosche F Malte 1 Nisan 2018 Strong coupling superconductivity in a quasiperiodic host guest structure Science Advances Ingilizce 4 4 eaao4793 doi 10 1126 sciadv aao4793 ISSN 2375 2548 PMC 5898833 2 PMID 29662950 17 Kasim 2020 tarihinde kaynagindan Erisim tarihi 18 Kasim 2020 a b Cheng Y Wang J Rao T He X Xu T 2008 Pharmaceutical applications of dendrimers promising nanocarriers for drug discovery 13 13 1447 1471 doi 10 2741 2774 Cheng Y Xu T 2005 Dendrimers as Potential Drug Carriers Part I Solubilization of Non Steroidal Anti Inflammatory Drugs in the Presence of Polyamidoamine Dendrimers 40 11 1188 1192 doi 10 1016 j ejmech 2005 06 010 Cheng Y Xu T Fu R 2005 Polyamidoamine dendrimers used as solubility enhancers of ketoprofen 40 12 1390 1393 doi 10 1016 j ejmech 2005 08 002 a b Cheng Y Xu Z Ma M Xu T 2007 Dendrimers as drug carriers Applications in different routes of drug administration 97 123 143 doi 10 1002 jps 21079 D Emanuele A Attwood D 2005 Dendrimer drug interactions 57 15 2147 2162 doi 10 1016 j addr 2005 09 012 PMID 16310283 Malik N Evagorou E Duncan R 1999 Dendrimer platinate a novel approach to cancer chemotherapy 10 8 767 776 doi 10 1097 00001813 199909000 00010 PMID 10573209 de Silva A P McCaughan B McKinney B O F Querol M 2003 Newer optical based molecular devices from older coordination chemistry Dalton Transactions 10 10 1902 1913 doi 10 1039 b212447p Anslyn E 2007 Supramolecular Analytical Chemistry Journal of Organic Chemistry 72 3 687 699 doi 10 1021 jo0617971 PMID 17253783 Nguyen B Anslyn E 2006 Indicator displacement assays 250 23 24 3118 3127 doi 10 1016 j ccr 2006 04 009 Yang V Fu Y Teng C Ma S Shanberge J 1994 A method for the quantitation of protamine in plasma PDF 74 4 427 434 doi 10 1016 0049 3848 94 90158 9 PMID 7521974 Eggleston A Rahim N Kowalczykowski S Ma S Shanberge J 1996 A method for the quantitation of protamine in plasma 24 7 1179 1186 doi 10 1093 nar 24 7 1179 PMC 145774 2 PMID 8614617 Atwood J Barbour L Jerga A Schottel L 2002 Guest Transport in a nonporous Organic Solid via Dynamic van der Waals Cooperativity Science 298 5595 1000 1002 Bibcode 2002Sci 298 1000A doi 10 1126 science 1077591 PMID 12411698 Kitagawa S Uemura K 2005 Dynamic porous properties of coordination polymers inspired by hydrogen bonds Chemical Society Reviews 34 2 109 119 doi 10 1039 b313997m PMID 15672175 Sozzani P Bracco S Commoti A Ferretti R Simonutti R 2005 Methane and Carbon Dioxide Storage in a Porous van der Waals Crystal Angewandte Chemie 44 12 1816 1820 doi 10 1002 anie 200461704 PMID 15662674 Uemura K Kitagawa S Fukui K Saito K 2004 A Contrivance for a Dynamic Porous Framework Cooperative Guest Adsorption Based on Square Grids Connected by Amide Amide Hydrogen Bonds J Am Chem Soc 126 12 3817 3828 doi 10 1021 ja039914m PMID 15038736 Dobrzanska L Lloyd G Esterhuysen C Barbour L 2006 Guest Induced Conformational Switching in a Single Crystal Angewandte Chemie 45 35 5856 5859 doi 10 1002 anie 200602057 PMID 16871642 Eric Hughes Jason Jordan Terry Gullion 2001 Structural Characterization of the Cs p tert butylcalix 4 arene H MeCN Guest Host System by 13C 133Cs REDOR NMR 105 25 5887 5891 doi 10 1021 jp004559x Serkan Erdemir Mufit Bahadir Mustafa Yilmaz 2009 Extraction of Carcinogenic Aromatic Amines from Aqueous Solution Using Calix n arene Derivatives as Carriers 168 2 3 1170 1176 doi 10 1016 j jhazmat 2009 02 150 PMID 19345489
 Azərbaycanca
Azərbaycanca Deutsch
Deutsch 日本語
日本語 Lietuvos
Lietuvos සිංහල
සිංහල Türkçe
Türkçe Українська
Українська United State
United State