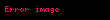Bir ideal gaz karışımında hacmi olan her gazın kendine ait bir kısmi basıncı vardır.
Gazlar derişiminden ziyade bu kısmi basınçlara göre çözünür, yayılır ve tepkimeye girerler.
Dalton'un kısmi basınç kanunu
Bir hacim içerisinde bulunan ideal gazlardan herhangi birinin kısmi basıncı, o gazın aynı hacimde başka bir kaba konduğunda ölçülen basıncı anlamına gelmektedir çünkü ideal gazların molekülleri birbiriyle etkileşemeyecek kadar birbirinden uzaktadır.
Bunun bir sonucu olarak bir ideal gazlar karışımının toplam basıncı, içinde bulunan gazların kısmi basınçları toplamına eşittir.
Örneğin, azot (N2), hidrojen (H2) ve amonyaktan (NH3) oluşan bir gaz karışımında:
| Öyle ki: | |
 | = Gazın toplam basıncı |
|---|---|
 | = Azotun (N2) kısmi basıncı |
 | = Hidrojenin (H2) kısmi basıncı |
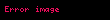 | = Amonyakın (NH3) kısmi basıncı |
İdeal gaz karışımları
Bir ideal gaz karışımı içerisinde bulunan herhangi bir gazın bileşenlerin kısmi basınçları cinsinden ifade edilebilir:
ve bir gazın kısmi basıncı şu ifade ile elde edilebilir:
| Öyle ki: | |
 | = Karışım içerisindeki herhangi bir gazın mol oranı |
|---|---|
 | = Karışım içerisindeki herhangi bir gazın kısmi basıncı |
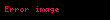 | = Karışım içerisindeki herhangi bir gazın mol sayısı |
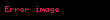 | = Karışımın toplam mol sayısı |
Ayrıca bakınız
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Bir ideal gaz karisiminda hacmi olan her gazin kendine ait bir kismi basinci vardir Gazlar derisiminden ziyade bu kismi basinclara gore cozunur yayilir ve tepkimeye girerler Dalton un kismi basinc kanunuBir hacim icerisinde bulunan ideal gazlardan herhangi birinin kismi basinci o gazin ayni hacimde baska bir kaba kondugunda olculen basinci anlamina gelmektedir cunku ideal gazlarin molekulleri birbiriyle etkilesemeyecek kadar birbirinden uzaktadir Bunun bir sonucu olarak bir ideal gazlar karisiminin toplam basinci icinde bulunan gazlarin kismi basinclari toplamina esittir Ornegin azot N2 hidrojen H2 ve amonyaktan NH3 olusan bir gaz karisiminda P PN2 PH2 PNH3 displaystyle P P mathrm N 2 P mathrm H 2 P mathrm NH 3 Oyle ki P displaystyle P Gazin toplam basinciPN2 displaystyle P mathrm N 2 Azotun N2 kismi basinciPH2 displaystyle P mathrm H 2 Hidrojenin H2 kismi basinciPNH3 displaystyle P mathrm NH 3 Amonyakin NH3 kismi basinciIdeal gaz karisimlariBir ideal gaz karisimi icerisinde bulunan herhangi bir gazin bilesenlerin kismi basinclari cinsinden ifade edilebilir xi PiP nin displaystyle x mathrm i frac P mathrm i P frac n mathrm i n ve bir gazin kismi basinci su ifade ile elde edilebilir Pi xi P displaystyle P mathrm i x mathrm i cdot P Oyle ki xi displaystyle x mathrm i Karisim icerisindeki herhangi bir gazin mol oraniPi displaystyle P mathrm i Karisim icerisindeki herhangi bir gazin kismi basincini displaystyle n mathrm i Karisim icerisindeki herhangi bir gazin mol sayisin displaystyle n Karisimin toplam mol sayisiAyrica bakinizAerostatik
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans