Biyokimyada Michaelis–Menten kinetiği, enzim kinetiğinin en basit ve en iyi modellerinden biridir. Alman biyokimyacı ve Kanadalı hekim 'e atfen adlandırılmıştır. Bu model, hızını betimleyen bir denklem şeklindedir, reaksiyon hızı , bir substrat S'nin konsantrasyonu cinsinden ifade edilir:

Burada, sistemden elde edilebilecek en yüksek reaksiyon hızıdır, enzimi doyurucu substrat konsantrasyonunda bu hıza ulaşılır. Michaelis sabiti , reaksiyon hızının 'ın yarısı olduğu substrat konsantrasyonudur. Genelde tek substratlı biyokimya reaksiyonlarının Michaelis–Menten kinetiğine uyduğu varsayılır, modelin varsayımlarına bakılmadan.
Model

1903'te Fransız fizikokimyacısı , enzim reaksiyonların enzim ile substrat arasında bir bağ oluşması ile başladığını keşfetti. Onun bu çalışması, en basit enzimatik reaksiyon mekanizmalarından birinin kinetiği'ni çalışan Amerikalı biyokimyacı ve Kanadali hekim tarafından devam ettirildi. Bu iki araştırmacı, invertaz tarafından sükrozun glukoz ve fruktoza dönüştüğü hidroliz reaksiyonunu inceliyordu. 1913'te bu reaksiyon için bir matematik model önerdiler. Modelde bir E enzimi bir S bağlanıp bir enzim-substrat kompleksi oluşturmakta, bu da enzim artı bir P dönüştürülmekteydi. Şematik olarak bu dönüşüm şöyle gösterilebilir:
burada 


Bazı varsayımlar ile – enzim konsantrasyonun substrat konsantrasyonundan çok daha düşük olması gibi - ürün oluşum hızı şu denklemle gösterilebilir:
Reaksiyon hızı 
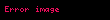
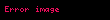



Michaelis sabiti 

Uygulamalar
Parametreler enzimden enzime büyük farklılık gösterebilir:
| Enzim |  (M) (M) |  (1/s) (1/s) |  (1/M.s) (1/M.s) |
|---|---|---|---|
| 1.5 × 10−2 | 0.14 | 9.3 | |
| Pepsin | 3.0 × 10−4 | 0.50 | 1.7 × 103 |
| 9.0 × 10−4 | 7.6 | 8.4 × 103 | |
| Ribonükleaz | 7.9 × 10−3 | 7.9 × 102 | 1.0 × 105 |
| Karbonik anhidraz | 2.6 × 10−2 | 4.0 × 105 | 1.5 × 107 |
| 5.0 × 10−6 | 8.0 × 102 | 1.6 × 108 |

Bu model, enzim-substrat etkileşimi dışında çeşitli biyokimyasal durumlar için de kullanılır, , ve protein-protein etkileşimi gibi. Jenerik bir biyokimyasal bir reaksiyonun karakterizasyonu için de kullanılabilir, biyomoleküler molekül adsorpsiyonu jenerik olarak modellemek için kullanılması gibi. Michaelis-Menten kinetiği biyokimyasal reaksiyonlar dışında çeşitli alanlarda da kullanılmıştır, akciğer alveollerinden toz giderilmesi, popülasyonlarda biyolojik tür sayısının zenginliği, giderilmesi, ve bakteriyel faj enfeksiyonu gibi.
Türetme
, bir reaksiyon hızının reaktanların konsantrasyonların çarpımı ile orantılı olduğunu belirtir. Bu kanun uygulanarak reaktanların miktarındaki 
Bu mekanizmada E enzimi, sadece reaksiyonu kolaylaştıran bir katalizördür, dolayısıyla onun serbest ve bağlı halleri için toplam konsantrasyonu, 
Hızlı denge yaklaşımı
Orijinal analizlerinde Michaelis ve Menten, substrat ile kompleksin kimyasal denge içinde olduklarını ve dolayısıyla 
Burada
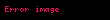
Burada 
Sürekli hal yaklaşımı
alternatif bir analizi Britanyalı botanikçi ve Britanyalı genetikçi J. B. S. Haldane tarafından 1925'te yapıldı. Bu araştırmacılar, ürünün oluştuğu zaman ölçeğinde, ara ürün kompleksinin konsantrasyonunun değişmediğini varsaydılar; bu varsayım, "kararlı hâlimsilik varsayımı" (veya "kararlı hâl benzerliği varsayımı"; İng. quasi-steady-state assumption) veya "sahte kararlı hâl hipotezi" (pseudo-steady-state-hypothesis) olarak adlandırılır. Matematiksel olarak, bu varsayım 
Burada
,
Michaelis sabiti olarak bilinir. Dolayısıyla reaksiyon hızı 
Varsayımlar ve sınırlamalar
Denklemin türetmesindeki ilk adım, kütle etkisi kanununu kullanır, ki bu serbest difüzyona dayalıdır. Oysa, canlı bir hücrenin içinde yüksek bir protein konsantrasyonu vardır, sitoplazma sıvıdan çok bir jel gibi davranır, bu yüzden molekül hareketleri sınırlıdır ve reaksiyon hızları bundan etkilenir. Kütle etkisi kanunu heterojen ortamlar için geçerli olsa da, sitoplazmanın sınırlı hareket kinetiği özelliğinin bir fraktal olarak modellenmesi daha uygun bulunmuştur.
İki yaklaşımla elde edilen reaksiyon hızı denklemleri benzerdir, aradaki fark, denge yaklaştırmasındaki sabitin 

teriminin küçük olması gerekir. Buna karşın, Briggs-Haldane kararlı hâlimsilik analizinin doğru olması için
teriminin küçük olması gerekmektedir. Dolayısıyla, onun geçerli olması için enzim konsantrasyonu substratınkinden çok daha az olmalıdır. Bu şart sağlanmasa dahi, eğer 
Hem Michaelis-Menten hem Briggs-Haldane analizinde, 
Sabitlerin belirlenmesi



Doğrusal olmayan regresyon yapmak için, eskiden bilgisayarlar mevcut değilken, denklemin doğrusallaştırılmasını sağlayan grafik yöntemler kullanılırdı: , ve bunlardan bazılarıdır; Hanes–Woolf grafiği en hatasızıdır. Ancak, görselleştirme için faydalı olsalar da, her üç yöntem de verilerdeki hata dağılımını bozduğu için, doğrusal olmayan regresyonla sabitlerin bulunması kadar sağlıklı değildir. Buna rağmen, modern literatürde bu grafik yöntemler hâlâ kullanılmaktadır.
Uzantılar
Michaelis ve Menten, tek substratlı ve tersinmez ürün oluşumlu basit reaksiyonların kinetiğini incelediler. Bu teori daha sonra genişletilmiştir, kararlı hâlimsilik yaklaştırmasını daha karmaşık sistemler için de uygulayarak. Bazı örnekler aşağıda verilmiştir.
Yarışmalı inhibisyon
Bir bileşik, enzimin substrat bağlanma yerine bağlanıp enzimin reaksiyonu katalizlemesini engellerse, meydana gelir. Bu durumda inhibitör sistemin 
burada
görünür 

Yarışmasız inhibisyon
Bir bileşik, enzim üzerinde substrat bağlanma yerinden farklı bir yere bağlanıp 
burada
.
Kaynakça
- ^ Henri, Victor (1903). Lois Générales de l’Action des Diastases. Paris: Hermann.
- ^ "Victor Henri". Whonamedit?. 4 Mart 2016 tarihinde kaynağından . Erişim tarihi: 24 Mayıs 2011.
- ^ a b = Menten, L.; Michaelis, M.I. (1913), "Die Kinetik der Invertinwirkung", Biochem Z, cilt 49, ss. 333-369 (İngilizceye çevirisi 29 Nisan 2020 tarihinde Wayback Machine sitesinde .)
- ^ a b Lehninger, A.L.; Nelson, D.L.; Cox, M.M. (2005). Lehninger principles of biochemistry. New York: W.H. Freeman. ISBN .
- ^ a b c Mathews, C.K.; van Holde, K.E.; Ahern, K.G. (10 Aralık 1999). [ttp://www.pearsonhighered.com/mathews/ Biochemistry] (3 bas.). Prentice Hall. ISBN .
- ^ Stroppolo, M.E.; Falconi, M.; Caccuri, A.M.; Desideri, A. (Eylül 2001). "Superefficient enzymes". Cell Mol Life Sci. 58 (10). ss. 1451-60. doi:10.1007/PL00000788. (PMID) 11693526.
- ^ a b Chakraborty, S. (23 Aralık 2009). Microfluidics and Microfabrication (1 bas.). Springer. ISBN .
- ^ Chen, W.W.; Neipel, M.; Sorger, P.K. (2010). "Classic and contemporary approaches to modeling biochemical reactions". Genes Dev. 24 (17). ss. 1861-1875. doi:10.1101/gad.1945410. (PMC) 2932968 $2. (PMID) 20810646.
- ^ Yu, R.C.; Rappaport, S.M. (1997). "A lung retention model based on Michaelis-Menten-like kinetics". Environ Health Perspect. 105 (5). ss. 496-503. doi:10.1289/ehp.97105496. (PMC) 1469867 $2. (PMID) 9222134.
- ^ Keating, K.A.; Quinn, J.F. (1998). "Estimating species richness: the Michaelis-Menten model revisited". Oikos. 81 (2). ss. 411-416. doi:10.2307/3547060. JSTOR 3547060.
- ^ Jones, A.W. (2010). "Evidence-based survey of the elimination rates of ethanol from blood with applications in forensic casework". Forensic Sci Int. 200 (1–3). ss. 1-20. doi:10.1016/j.forsciint.2010.02.021. (PMID) 20304569.
- ^ Abedon, S.T. (2009). "Kinetics of phage-mediated biocontrol of bacteria". Foodborne Pathog Dis. 6 (7). ss. 807-15. doi:10.1089/fpd.2008.0242. (PMID) 19459758.
- ^ a b c Murray, J.D. (2002). Mathematical Biology: I. An Introduction (3 bas.). Springer. ISBN .
- ^ a b c d e f g h Keener, J.; Sneyd, J. (2008). Mathematical Physiology: I: Cellular Physiology (2 bas.). Springer. ISBN .
- ^ Briggs, G.E.; Haldane, J.B.S. (1925). "A note on the kinematics of enzyme action". Biochem J. 19 (2). ss. 338-339. (PMC) 1259181 $2. (PMID) 16743508.
- ^ Zhou, H.X.; Rivas, G.; Minton, A.P. (2008). "Macromolecular crowding and confinement: biochemical, biophysical, and potential physiological consequences". Annu Rev Biophys. Cilt 37. ss. 375-97. doi:10.1146/annurev.biophys.37.032807.125817. (PMC) 2826134 $2. (PMID) 18573087.
- ^ Grima, R.; Schnell, S. (Ekim 2006). "A systematic investigation of the rate laws valid in intracellular environments". Biophys Chem. 124 (1). ss. 1-10. doi:10.1016/j.bpc.2006.04.019. (PMID) 16781049.
- ^ Schnell, S.; Turner, T.E. (2004). "Reaction kinetics in intracellular environments with macromolecular crowding: simulations and rate laws". Prog Biophys Mol Biol. 85 (2–3). ss. 235-60. doi:10.1016/j.pbiomolbio.2004.01.012. (PMID) 15142746.
- ^ a b Segel, L.A.; Slemrod, M. (1989). "The quasi-steady-state assumption: A case study in perturbation". Thermochim Acta. 31 (3). ss. 446-477. doi:10.1137/1031091.
- ^ a b Leskovac, V. (2003). Comprehensive enzyme kinetics. New York: Kluwer Academic/Plenum Pub. ISBN .
- ^ Greco, W.R.; Hakala, M.T. (1979). "Evaluation of methods for estimating the dissociation constant of tight binding enzyme inhibitors,". J Biol Chem. 254 (23). ss. 12104-12109. (PMID) 500698.
- ^ Hayakawa, K.; Guo, L.; Terentyeva, E.A.; Li, X.K.; Kimura, H.; Hirano, M.; Yoshikawa, K.; Nagamine, T.; Katsumata, N. (2006). "Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei (Shirota)". J Chromatogr B Analyt Technol Biomed Life Sci. 844 (2). ss. 240-50. doi:10.1016/j.jchromb.2006.07.006. (PMID) 16876490.
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Biyokimyada Michaelis Menten kinetigi enzim kinetiginin en basit ve en iyi modellerinden biridir Alman biyokimyaci ve Kanadali hekim e atfen adlandirilmistir Bu model hizini betimleyen bir denklem seklindedir reaksiyon hizi V displaystyle V bir substrat S nin konsantrasyonu cinsinden ifade edilir Michaelis Menten kinetigine uyan bir enzim reaksiyonu icin doyum egrisi bu ornekte Vmax 3 4 ve Km 0 4 v Vmax S Km S displaystyle v frac V max S K m S Burada Vmax displaystyle V max sistemden elde edilebilecek en yuksek reaksiyon hizidir enzimi doyurucu substrat konsantrasyonunda bu hiza ulasilir Michaelis sabiti Km displaystyle K m reaksiyon hizinin Vmax displaystyle V max in yarisi oldugu substrat konsantrasyonudur Genelde tek substratli biyokimya reaksiyonlarinin Michaelis Menten kinetigine uydugu varsayilir modelin varsayimlarina bakilmadan ModelE enzimi S substrati ES kompleksi ve P urunu icin zamana bagli konsantrasyon degisimleri 1903 te Fransiz fizikokimyacisi enzim reaksiyonlarin enzim ile substrat arasinda bir bag olusmasi ile basladigini kesfetti Onun bu calismasi en basit enzimatik reaksiyon mekanizmalarindan birinin kinetigi ni calisan Amerikali biyokimyaci ve Kanadali hekim tarafindan devam ettirildi Bu iki arastirmaci invertaz tarafindan sukrozun glukoz ve fruktoza donustugu hidroliz reaksiyonunu inceliyordu 1913 te bu reaksiyon icin bir matematik model onerdiler Modelde bir E enzimi bir S baglanip bir enzim substrat kompleksi olusturmakta bu da enzim arti bir P donusturulmekteydi Sematik olarak bu donusum soyle gosterilebilir E S krkfES kcatE P displaystyle E S overset k f underset k r rightleftharpoons ES overset k cat longrightarrow E P burada kf displaystyle k f kr displaystyle k r ve kcat displaystyle k cat S ve ES arasindaki cifte oklar enzim substrat baglanmasinin oldugunu belirtir Bazi varsayimlar ile enzim konsantrasyonun substrat konsantrasyonundan cok daha dusuk olmasi gibi urun olusum hizi su denklemle gosterilebilir v Vmax S Km S kcat E 0 S Km S displaystyle v V max frac S K m S k text cat E 0 frac S K m S Reaksiyon hizi S displaystyle S ile birlikte artar asimptotik olarak maksimum hiz Vmax displaystyle V max a yaklasir Vmax displaystyle V max da tum enzim molekulleri substrata baglidir Dolayisiyla Vmax kcat E 0 displaystyle V max k text cat E 0 burada E 0 displaystyle E 0 enzim konsantrasyonudur kcat displaystyle k cat bir enzim molekulu tarafindan bir saniyede substrata donusturulen maksimum substrat molekul sayisidir donusum sayisi veya etkinlik sayisi veya turnover sayisi olarak adlandirilir Michaelis sabiti Km displaystyle K m reaksiyon hizinin yari maksimum oldugu substrat konsantrasyonudur ve substratin enzime baglanma ilgisinin bir olcusu sayilir Kucuk bir Km displaystyle K m yuksek bir afinite olduguna isaret eder yani reaksiyon hizi Vmax displaystyle V max a daha cabuk ulasir UygulamalarParametreler enzimden enzime buyuk farklilik gosterebilir Enzim Km displaystyle K m M kcat displaystyle k text cat 1 s kcat Km displaystyle k text cat K m 1 M s 1 5 10 2 0 14 9 3Pepsin 3 0 10 4 0 50 1 7 1039 0 10 4 7 6 8 4 103Ribonukleaz 7 9 10 3 7 9 102 1 0 105Karbonik anhidraz 2 6 10 2 4 0 105 1 5 1075 0 10 6 8 0 102 1 6 108 kcat Km displaystyle k text cat K m sabiti enzimin substrati urune donusturmekte ne kadar verimli oldugunun bir gostergesidir Teorik ust siniri nowrap 108 1010 M s dir bu degere yakin olan fumaraz gibi enzimler icin super verimli terimi kullanilir Bu model enzim substrat etkilesimi disinda cesitli biyokimyasal durumlar icin de kullanilir ve protein protein etkilesimi gibi Jenerik bir biyokimyasal bir reaksiyonun karakterizasyonu icin de kullanilabilir biyomolekuler molekul adsorpsiyonu jenerik olarak modellemek icin kullanilmasi gibi Michaelis Menten kinetigi biyokimyasal reaksiyonlar disinda cesitli alanlarda da kullanilmistir akciger alveollerinden toz giderilmesi populasyonlarda biyolojik tur sayisinin zenginligi giderilmesi ve bakteriyel faj enfeksiyonu gibi Turetme bir reaksiyon hizinin reaktanlarin konsantrasyonlarin carpimi ile orantili oldugunu belirtir Bu kanun uygulanarak reaktanlarin miktarindaki t displaystyle t zamanina bagli degisimi ifade eden dort dogrusal olmayan adi diferansiyel denklem elde edilir d S dt kf E S kr ES d E dt kf E S kr ES kcat ES d ES dt kf E S kr ES kcat ES d P dt kcat ES displaystyle begin array ccccc d S dt amp amp k f E S amp k r ES amp d E dt amp amp k f E S amp k r ES amp k cat ES d ES dt amp amp k f E S amp k r ES amp k cat ES d P dt amp amp amp amp k cat ES end array Bu mekanizmada E enzimi sadece reaksiyonu kolaylastiran bir katalizordur dolayisiyla onun serbest ve bagli halleri icin toplam konsantrasyonu E ES E 0 displaystyle E ES E 0 bir sabittir Bu koruma yasasi yukaridaki ikinci ve ucuncu denklemlerin toplanmasiyla da elde edilebilir Hizli denge yaklasimi Orijinal analizlerinde Michaelis ve Menten substrat ile kompleksin kimyasal denge icinde olduklarini ve dolayisiyla kf E S kr ES displaystyle k f E S k r ES oldugunu varsaymislardir Bu esitlik ile enzim korunum kanunu birlestirilirse kompleksin konsantrasyonu suna esittir ES E 0 S Kd S displaystyle ES frac E 0 S K d S BuradaKd kr kf displaystyle K d k r k f enzim substrat kompleksinin Dolayisiyla reaksiyonun v displaystyle v hizi yani P urununun olusum hizi sudur v d P dt Vmax S Kd S displaystyle v d P dt frac V max S K d S Burada Vmax kcat E 0 displaystyle V max k cat E 0 maksimum reaksiyon hizidir Surekli hal yaklasimi alternatif bir analizi Britanyali botanikci ve Britanyali genetikci J B S Haldane tarafindan 1925 te yapildi Bu arastirmacilar urunun olustugu zaman olceginde ara urun kompleksinin konsantrasyonunun degismedigini varsaydilar bu varsayim kararli halimsilik varsayimi veya kararli hal benzerligi varsayimi Ing quasi steady state assumption veya sahte kararli hal hipotezi pseudo steady state hypothesis olarak adlandirilir Matematiksel olarak bu varsayim kf E S kr ES kcat ES displaystyle k f E S k r ES k cat ES anlamina gelir Bu esitlik ile enzim korunum kanun birlestirilince ES kompleksin konsantrasyonu sudur ES E 0 S Km S displaystyle ES frac E 0 S K m S Burada Km kr kcatkf displaystyle K m frac k r k cat k f Michaelis sabiti olarak bilinir Dolayisiyla reaksiyon hizi v displaystyle v icin su sonuc cikar v d P dt Vmax S Km S displaystyle v d P dt frac V max S K m S Varsayimlar ve sinirlamalar Denklemin turetmesindeki ilk adim kutle etkisi kanununu kullanir ki bu serbest difuzyona dayalidir Oysa canli bir hucrenin icinde yuksek bir protein konsantrasyonu vardir sitoplazma sividan cok bir jel gibi davranir bu yuzden molekul hareketleri sinirlidir ve reaksiyon hizlari bundan etkilenir Kutle etkisi kanunu heterojen ortamlar icin gecerli olsa da sitoplazmanin sinirli hareket kinetigi ozelliginin bir fraktal olarak modellenmesi daha uygun bulunmustur Iki yaklasimla elde edilen reaksiyon hizi denklemleri benzerdir aradaki fark denge yaklastirmasindaki sabitin Kd displaystyle K d olarak tanimlanmasi kararli halimsilik yaklastirmasinin ise Km displaystyle K m yi kullanmasidir Ancak bu iki yaklasim farkli varsayimlara dayandirilmistir Michaelis Menten denge analizinin dogru olmasi icin substratin dengeye yaklasma hizinin urun olusumundan cok daha hizli olmasi gerekir veya daha kesin olarak ϵd kcatkr 1 displaystyle epsilon d frac k cat k r ll 1 teriminin kucuk olmasi gerekir Buna karsin Briggs Haldane kararli halimsilik analizinin dogru olmasi icin ϵm E 0 S 0 Km 1 displaystyle epsilon m frac E 0 S 0 K m ll 1 teriminin kucuk olmasi gerekmektedir Dolayisiyla onun gecerli olmasi icin enzim konsantrasyonu substratinkinden cok daha az olmalidir Bu sart saglanmasa dahi eger Km displaystyle K m buyukse bu yaklastirma gecerlidir Hem Michaelis Menten hem Briggs Haldane analizinde ϵ displaystyle epsilon kuculdukce yaklastirmanin kalitesi iyilesir Ancak enzim reaksiyonlarinin modellemesinde varsayimlar gozden gecirilmeden genelde Michaelis Menten kinetiginin kullanilma egilimi vardir Sabitlerin belirlenmesiVmax displaystyle V max ve Km displaystyle K m sabitlerinin belirlenmesi icin tipik yontem farkli substrat konsantrasyonlarinda S displaystyle S bir seri enzim olcumu yapilmasi ve reaksiyon ilk hizinin v0 displaystyle v 0 olculmesidir Burada ilk teriminden kasit reaksiyon hizinin baslangictan sonraki nispeten kisa bir sure icinde olculmesidir bu sure zarfinda enzim substrat kompleksinin olusmus oldugu ama substrat konsantrasyonun yaklasik sabit oldugu ve dolayisiyla denge veya kararli halimsilik yaklastirmasinin gecerli oldugu varsayilir Reaksiyon hizini konsantrasyona gore grafikleyince ve Michaelis Menten denklemi ile dogrusal olmayan regresyon yaparak parametreler elde edilebilir Dogrusal olmayan regresyon yapmak icin eskiden bilgisayarlar mevcut degilken denklemin dogrusallastirilmasini saglayan grafik yontemler kullanilirdi ve bunlardan bazilaridir Hanes Woolf grafigi en hatasizidir Ancak gorsellestirme icin faydali olsalar da her uc yontem de verilerdeki hata dagilimini bozdugu icin dogrusal olmayan regresyonla sabitlerin bulunmasi kadar saglikli degildir Buna ragmen modern literaturde bu grafik yontemler hala kullanilmaktadir UzantilarMichaelis ve Menten tek substratli ve tersinmez urun olusumlu basit reaksiyonlarin kinetigini incelediler Bu teori daha sonra genisletilmistir kararli halimsilik yaklastirmasini daha karmasik sistemler icin de uygulayarak Bazi ornekler asagida verilmistir Yarismali inhibisyon Bir bilesik enzimin substrat baglanma yerine baglanip enzimin reaksiyonu katalizlemesini engellerse meydana gelir Bu durumda inhibitor sistemin Km displaystyle K m sini degistirir reaksiyon hizi su sekilde degisir v kcat E 0 S Kmapp S displaystyle v k text cat E 0 frac S K m text app S burada Kmapp Km 1 I KI displaystyle K m text app K m left 1 frac I K I right gorunur Km displaystyle K m dir I inhibitor bilesiktir KI displaystyle K I de onun ayrisma sabitidir Yarismasiz inhibisyon Bir bilesik enzim uzerinde substrat baglanma yerinden farkli bir yere baglanip kcat displaystyle k text cat degerini degistirirse meydana gelir Reaksiyon hizi soyle degisir v kcatapp E 0 S Km S displaystyle v k text cat text app E 0 frac S K m S burada kcatapp kcatKIKI I displaystyle k text cat text app k text cat frac K I K I I Kaynakca Henri Victor 1903 Lois Generales de l Action des Diastases Paris Hermann Victor Henri Whonamedit 4 Mart 2016 tarihinde kaynagindan Erisim tarihi 24 Mayis 2011 a b Menten L Michaelis M I 1913 Die Kinetik der Invertinwirkung Biochem Z cilt 49 ss 333 369 Ingilizceye cevirisi 29 Nisan 2020 tarihinde Wayback Machine sitesinde a b Lehninger A L Nelson D L Cox M M 2005 Lehninger principles of biochemistry New York W H Freeman ISBN 978 0 7167 4339 2 a b c Mathews C K van Holde K E Ahern K G 10 Aralik 1999 ttp www pearsonhighered com mathews Biochemistry 3 bas Prentice Hall ISBN 978 0805330663 Stroppolo M E Falconi M Caccuri A M Desideri A Eylul 2001 Superefficient enzymes Cell Mol Life Sci 58 10 ss 1451 60 doi 10 1007 PL00000788 PMID 11693526 a b Chakraborty S 23 Aralik 2009 Microfluidics and Microfabrication 1 bas Springer ISBN 978 1441915429 Chen W W Neipel M Sorger P K 2010 Classic and contemporary approaches to modeling biochemical reactions Genes Dev 24 17 ss 1861 1875 doi 10 1101 gad 1945410 PMC 2932968 2 PMID 20810646 Yu R C Rappaport S M 1997 A lung retention model based on Michaelis Menten like kinetics Environ Health Perspect 105 5 ss 496 503 doi 10 1289 ehp 97105496 PMC 1469867 2 PMID 9222134 Keating K A Quinn J F 1998 Estimating species richness the Michaelis Menten model revisited Oikos 81 2 ss 411 416 doi 10 2307 3547060 JSTOR 3547060 Jones A W 2010 Evidence based survey of the elimination rates of ethanol from blood with applications in forensic casework Forensic Sci Int 200 1 3 ss 1 20 doi 10 1016 j forsciint 2010 02 021 PMID 20304569 Abedon S T 2009 Kinetics of phage mediated biocontrol of bacteria Foodborne Pathog Dis 6 7 ss 807 15 doi 10 1089 fpd 2008 0242 PMID 19459758 a b c Murray J D 2002 Mathematical Biology I An Introduction 3 bas Springer ISBN 978 0387952239 a b c d e f g h Keener J Sneyd J 2008 Mathematical Physiology I Cellular Physiology 2 bas Springer ISBN 978 0387758466 Briggs G E Haldane J B S 1925 A note on the kinematics of enzyme action Biochem J 19 2 ss 338 339 PMC 1259181 2 PMID 16743508 Zhou H X Rivas G Minton A P 2008 Macromolecular crowding and confinement biochemical biophysical and potential physiological consequences Annu Rev Biophys Cilt 37 ss 375 97 doi 10 1146 annurev biophys 37 032807 125817 PMC 2826134 2 PMID 18573087 Grima R Schnell S Ekim 2006 A systematic investigation of the rate laws valid in intracellular environments Biophys Chem 124 1 ss 1 10 doi 10 1016 j bpc 2006 04 019 PMID 16781049 Schnell S Turner T E 2004 Reaction kinetics in intracellular environments with macromolecular crowding simulations and rate laws Prog Biophys Mol Biol 85 2 3 ss 235 60 doi 10 1016 j pbiomolbio 2004 01 012 PMID 15142746 a b Segel L A Slemrod M 1989 The quasi steady state assumption A case study in perturbation Thermochim Acta 31 3 ss 446 477 doi 10 1137 1031091 a b Leskovac V 2003 Comprehensive enzyme kinetics New York Kluwer Academic Plenum Pub ISBN 978 0 306 46712 7 Greco W R Hakala M T 1979 Evaluation of methods for estimating the dissociation constant of tight binding enzyme inhibitors J Biol Chem 254 23 ss 12104 12109 PMID 500698 Hayakawa K Guo L Terentyeva E A Li X K Kimura H Hirano M Yoshikawa K Nagamine T Katsumata N 2006 Determination of specific activities and kinetic constants of biotinidase and lipoamidase in LEW rat and Lactobacillus casei Shirota J Chromatogr B Analyt Technol Biomed Life Sci 844 2 ss 240 50 doi 10 1016 j jchromb 2006 07 006 PMID 16876490
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans
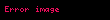
![{\displaystyle v={\frac {V_{\max[}S]}{K_{m}+[S]}}.}](https://www.wikipedia.tr-tr.nina.az/image/aHR0cHM6Ly93d3cud2lraXBlZGlhLnRyLXRyLm5pbmEuYXovaW1hZ2UvYUhSMGNITTZMeTkzYVd0cGJXVmthV0V1YjNKbkwyRndhUzl5WlhOMFgzWXhMMjFsWkdsaEwyMWhkR2d2Y21WdVpHVnlMM04yWnk5a01EZ3hPRGRqTVRGbFpXTmtOV001TXpNM1lqYzJNemhsWkdNNU1qaGhaV000Tm1Fd1l6ZGwuc3Zn.svg)













