Kimya ve biyokimyada ayrışma, moleküllerin (veya tuzlar veya bileşikler gibi iyonik bileşiklerin) atomlar, iyonlar veya radikaller gibi daha küçük parçacıklara ayrıldığı genel bir süreçtir. Örneğin, bir asit suda çözündüğünde, bir elektronegatif atom ile bir hidrojen atomu arasındaki kovalent bir bağ, bir proton (H+) ve bir negatif iyon veren heterolitik fisyon tarafından kırılır. Ayrışma, birleşme veya rekombinasyonun tersidir.
Ayrışma sabiti
Kimyasal bir dengede tersinir ayrışmalar için
- AB
![image]() A + B
A + B
Kd ayrışma sabiti, ayrışanların çözülmemiş bileşiğe oranıdır
parantezler türlerin denge konsantrasyonlarını gösterir.
Ayrışma derecesi
Ayrışma derecesi, ayrışmış orijinal çözünen moleküllerin fraksiyonudur. Genellikle Yunan sembolü α ile gösterilir. Daha doğrusu, ayrışma derecesi, mol başına iyonlara veya radikallere ayrışan çözünen madde miktarını ifade eder. Çok güçlü asitler ve bazlar durumunda, ayrışma derecesi 1'e yakın olacaktır. Daha az güçlü asitler ve bazlar daha az ayrışma derecesine sahip olacaktır. Bu parametre ile 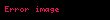
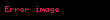
Örneğin, aşağıdaki ayrışma için
- KCl
![image]() K + + Cl -
K + + Cl -
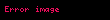

Tuzlar
Ayrıca bakınız:
Tuzların su gibi bir çözelti içinde çözülerek ayrışması, anyonların ve katyonların ayrılması anlamına gelir. Tuz, çözücünün buharlaştırılmasıyla geri kazanılabilir.
Bir elektrolit, serbest iyonlar içeren ve elektriksel olarak iletken bir ortam olarak kullanılabilen bir maddeyi ifade eder. Çözünen maddenin çoğu zayıf bir elektrolit içinde ayrışmazken, güçlü bir elektrolitte daha yüksek bir çözünen madde oranı ayrışarak serbest iyonlar oluşturur.
Zayıf bir elektrolit, çözelti içinde çoğunlukla molekül formunda bulunan ("ayrışmamış" olduğu söylenen), iyon şeklinde sadece küçük bir fraksiyonu olan bir maddedir. Basitçe bir maddenin kolayca ayrışmaması onu zayıf bir elektrolit yapmaz. Asetik asit (CH3COOH) ve amonyum (NH4+) iyi örneklerdir. Asetik asit suda son derece çözünür, ancak bileşiğin çoğu moleküller halinde çözünerek onu zayıf bir elektrolit haline getirir. Zayıf bazlar ve zayıf asitler genellikle zayıf elektrolitlerdir. Sulu bir çözelti içinde bir miktar CH3COOH ve bir miktar da CH3COO− ve ortaya H+ çıkacaktır.
Güçlü bir elektrolit, çözeltide tamamen veya neredeyse tamamen iyonlar halinde bulunan bir çözünen maddedir. Yine, bir elektrolitin gücü, moleküllerden ziyade iyon olan çözünen madde yüzdesi olarak tanımlanır. Yüzde ne kadar yüksekse, elektrolit o kadar güçlüdür. Bu nedenle, bir madde çok çözünür olmasa da, tamamen iyonlara ayrışsa bile, madde güçlü bir elektrolit olarak tanımlanır. Zayıf bir elektrolit için de benzer mantık geçerlidir. Güçlü asitler ve bazlar, HCl ve H2SO4 iyi örneklerdir. Bunların hepsi sulu bir ortamda iyonlar olarak var olacaktır.
Gazlar
Gazlardaki ayrışma derecesi, α sembolü ile gösterilir, burada α, çözünen gaz moleküllerinin yüzdesini belirtir. Denklemin stokiyometrisine bağlı olarak Kp ve α arasında çeşitli ilişkiler mevcuttur. Örnek olarak diazot tetroksit (N2O4) ile ayrışan nitrojen dioksit (NO2) alınacaktır.
- N 2 O 4
![image]() 2 NO 2
2 NO 2
Diazot tetroksit başlangıç konsantrasyonu litre başına 1 mol ise, bu, denge verirken α ile, stokiyometri ile, NO2'nin 2α molleri ile azalacaktır.. Denge sabiti (basınç cinsinden) şu denklem ile gösterilir:
P, kısmi basıncı temsil eder. Bu nedenle, kısmi basıncın tanımı ve toplam basıncı temsil etmek için pT ve mol fraksiyonunu temsil etmek için x kullanırsak;
Dengedeki toplam mol sayısı (1-α) + (2α) 'dır ve 1+α'ya eşdeğerdir. Böylece mol fraksiyonlarının alfa cinsinden gerçek değerlerle ikame edilmesi ve basitleştirilmesi;
Bu denklem Le Chatelier'in İlkesine uygundur. Kp sıcaklıkla sabit kalacaktır. Sisteme basınç eklenmesi, pT değerini artıracaktır, bu nedenle α, Kp'yi sabit tutmak için düşmelidir. Aslında, dengenin basıncının arttırılması, dinitrojen tetroksit oluşumunu destekleyen sola kaymaya yardımcı olur (dengenin bu tarafında olduğu gibi, basınç mol sayısı ile orantılı olduğundan daha az basınç vardır), dolayısıyla α ayrışma kapsamını azaltır.
Sulu çözelti içindeki asitler
Bir asitin su çözücüsünde reaksiyonu genellikle bir ayrışma olarak tanımlanır

burada, HA, örneğin asetik asit, CH3COOH gibi bir proton asittir. Çift ok, ayrışmanın ve rekombinasyonun aynı anda meydana geldiği bir denge sürecinin gerçekleştiği anlamına gelir. Bu, asit ayrışma sabiti anlamına gelir
Bununla birlikte, Brønsted-Lowry asit-baz teorisi, proton H+'nın çözelti içinde mevcut olmadığını, bunun yerine hidronyum iyonu H3O+ oluşturmak için bir su molekülü tarafından kabul edildiğini (bağlandığını) belirten daha doğru bir açıklama sunar.
Reaksiyon bu nedenle şu şekilde daha doğru olarak yazılır

ve daha iyi bir iyonlaşma veya iyon oluşumu olarak tanımlanır (HA'nın net yükünün olmadığı durum için). Denge sabiti o zaman

Ka çeşitli bir ayrışma sabiti, bir asit iyonlaşma sabiti,:668 bir asit sabiti veya bir iyonizasyon sabiti gibi şekillerde adlandırılabilir.:708 Bu asit kuvvetinin bir göstergesi olarak hizmet eder: güçlü asitler daha yüksek bir Ka değerine (ve daha düşük bir pKa değerine) sahiptir.
Parçalanma
Bir molekülün parçalanması, bir heteroliz veya homoliz süreci ile gerçekleşebilir .
Reseptörler
Reseptörler, küçük ligandları bağlayan proteinlerdir . Ayrışma sabiti Kd ligandın reseptöre afinitesinin bir göstergesi olarak kullanılır. Reseptör için ligand afinitesi ne kadar yüksek olursa, Kddeğeri o kadar düşük olur (ve pKd değeri o kadar yüksek olur).
Ayrıca bakınız
- Bağ ayrışma enerjisi
- Foto ayrışma, moleküllerin fotonlarla ayrışması (ışık, gama ışınları, x-ışınları)
- Radyoliz, iyonlaştırıcı radyasyonla moleküllerin ayrışması
- Termal bozunma
Kaynakça
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Kimya ve biyokimyada ayrisma molekullerin veya tuzlar veya bilesikler gibi iyonik bilesiklerin atomlar iyonlar veya radikaller gibi daha kucuk parcaciklara ayrildigi genel bir surectir Ornegin bir asit suda cozundugunde bir elektronegatif atom ile bir hidrojen atomu arasindaki kovalent bir bag bir proton H ve bir negatif iyon veren heterolitik fisyon tarafindan kirilir Ayrisma birlesme veya rekombinasyonun tersidir Ayrisma sabitiKimyasal bir dengede tersinir ayrismalar icin AB A B Kd ayrisma sabiti ayrisanlarin cozulmemis bilesige oranidir Kd A B AB displaystyle K d mathrm frac A B AB parantezler turlerin denge konsantrasyonlarini gosterir Ayrisma derecesiAyrisma derecesi ayrismis orijinal cozunen molekullerin fraksiyonudur Genellikle Yunan sembolu a ile gosterilir Daha dogrusu ayrisma derecesi mol basina iyonlara veya radikallere ayrisan cozunen madde miktarini ifade eder Cok guclu asitler ve bazlar durumunda ayrisma derecesi 1 e yakin olacaktir Daha az guclu asitler ve bazlar daha az ayrisma derecesine sahip olacaktir Bu parametre ile i displaystyle i arasinda basit bir iliski vardir Cozunen madde n displaystyle n iyonlarina cozunurse o zaman i 1 a n 1 displaystyle i 1 alpha n 1 Ornegin asagidaki ayrisma icin KCl K Cl n 2 displaystyle n 2 icin i 1 a displaystyle i 1 alpha olacaktir TuzlarAyrica bakiniz Tuzlarin su gibi bir cozelti icinde cozulerek ayrismasi anyonlarin ve katyonlarin ayrilmasi anlamina gelir Tuz cozucunun buharlastirilmasiyla geri kazanilabilir Bir elektrolit serbest iyonlar iceren ve elektriksel olarak iletken bir ortam olarak kullanilabilen bir maddeyi ifade eder Cozunen maddenin cogu zayif bir elektrolit icinde ayrismazken guclu bir elektrolitte daha yuksek bir cozunen madde orani ayrisarak serbest iyonlar olusturur Zayif bir elektrolit cozelti icinde cogunlukla molekul formunda bulunan ayrismamis oldugu soylenen iyon seklinde sadece kucuk bir fraksiyonu olan bir maddedir Basitce bir maddenin kolayca ayrismamasi onu zayif bir elektrolit yapmaz Asetik asit CH3COOH ve amonyum NH4 iyi orneklerdir Asetik asit suda son derece cozunur ancak bilesigin cogu molekuller halinde cozunerek onu zayif bir elektrolit haline getirir Zayif bazlar ve zayif asitler genellikle zayif elektrolitlerdir Sulu bir cozelti icinde bir miktar CH3COOH ve bir miktar da CH3COO ve ortaya H cikacaktir Guclu bir elektrolit cozeltide tamamen veya neredeyse tamamen iyonlar halinde bulunan bir cozunen maddedir Yine bir elektrolitin gucu molekullerden ziyade iyon olan cozunen madde yuzdesi olarak tanimlanir Yuzde ne kadar yuksekse elektrolit o kadar gucludur Bu nedenle bir madde cok cozunur olmasa da tamamen iyonlara ayrissa bile madde guclu bir elektrolit olarak tanimlanir Zayif bir elektrolit icin de benzer mantik gecerlidir Guclu asitler ve bazlar HCl ve H2SO4 iyi orneklerdir Bunlarin hepsi sulu bir ortamda iyonlar olarak var olacaktir GazlarGazlardaki ayrisma derecesi a sembolu ile gosterilir burada a cozunen gaz molekullerinin yuzdesini belirtir Denklemin stokiyometrisine bagli olarak Kp ve a arasinda cesitli iliskiler mevcuttur Ornek olarak diazot tetroksit N2O4 ile ayrisan nitrojen dioksit NO2 alinacaktir N 2 O 4 2 NO 2 Diazot tetroksit baslangic konsantrasyonu litre basina 1 mol ise bu denge verirken a ile stokiyometri ile NO2 nin 2a molleri ile azalacaktir Denge sabiti basinc cinsinden su denklem ile gosterilir Kp p NO2 2p N2O4 displaystyle K p frac ce p NO2 2 ce p N2O4 P kismi basinci temsil eder Bu nedenle kismi basincin tanimi ve toplam basinci temsil etmek icin pT ve mol fraksiyonunu temsil etmek icin x kullanirsak Kp pT2 x NO2 2pT x N2O4 pT x NO2 2x N2O4 displaystyle K p frac ce p T 2 x NO2 2 ce p T cdot x N2O4 frac ce p T x NO2 2 ce x N2O4 Dengedeki toplam mol sayisi 1 a 2a dir ve 1 a ya esdegerdir Boylece mol fraksiyonlarinin alfa cinsinden gercek degerlerle ikame edilmesi ve basitlestirilmesi Kp pT 4a2 1 a 1 a pT 4a2 1 a2 displaystyle K p frac ce p T 4 alpha 2 1 alpha 1 alpha frac ce p T 4 alpha 2 1 alpha 2 Bu denklem Le Chatelier in Ilkesine uygundur Kp sicaklikla sabit kalacaktir Sisteme basinc eklenmesi pT degerini artiracaktir bu nedenle a Kp yi sabit tutmak icin dusmelidir Aslinda dengenin basincinin arttirilmasi dinitrojen tetroksit olusumunu destekleyen sola kaymaya yardimci olur dengenin bu tarafinda oldugu gibi basinc mol sayisi ile orantili oldugundan daha az basinc vardir dolayisiyla a ayrisma kapsamini azaltir Sulu cozelti icindeki asitlerBir asitin su cozucusunde reaksiyonu genellikle bir ayrisma olarak tanimlanir HA H A displaystyle ce HA lt gt H A burada HA ornegin asetik asit CH3COOH gibi bir proton asittir Cift ok ayrismanin ve rekombinasyonun ayni anda meydana geldigi bir denge surecinin gerceklestigi anlamina gelir Bu asit ayrisma sabiti anlamina gelir Ka H A HA displaystyle K ce a ce frac H A HA Bununla birlikte Bronsted Lowry asit baz teorisi proton H nin cozelti icinde mevcut olmadigini bunun yerine hidronyum iyonu H3O olusturmak icin bir su molekulu tarafindan kabul edildigini baglandigini belirten daha dogru bir aciklama sunar Reaksiyon bu nedenle su sekilde daha dogru olarak yazilir HA H2O H3O A displaystyle ce HA H2O lt gt H3O A ve daha iyi bir iyonlasma veya iyon olusumu olarak tanimlanir HA nin net yukunun olmadigi durum icin Denge sabiti o zaman Ka H3O A HA displaystyle K ce a ce frac H 3 O A HA H2O displaystyle ce H 2O dahil edilmemistir cunku seyreltik solusyonda cozucu esasen bir termodinamik aktiviteye sahip saf bir sividir 668 Ka cesitli bir ayrisma sabiti bir asit iyonlasma sabiti 668 bir asit sabiti veya bir iyonizasyon sabiti gibi sekillerde adlandirilabilir 708 Bu asit kuvvetinin bir gostergesi olarak hizmet eder guclu asitler daha yuksek bir Ka degerine ve daha dusuk bir pKa degerine sahiptir ParcalanmaBir molekulun parcalanmasi bir heteroliz veya homoliz sureci ile gerceklesebilir ReseptorlerReseptorler kucuk ligandlari baglayan proteinlerdir Ayrisma sabiti Kd ligandin reseptore afinitesinin bir gostergesi olarak kullanilir Reseptor icin ligand afinitesi ne kadar yuksek olursa Kddegeri o kadar dusuk olur ve pKd degeri o kadar yuksek olur Ayrica bakinizBag ayrisma enerjisi Foto ayrisma molekullerin fotonlarla ayrismasi isik gama isinlari x isinlari Radyoliz iyonlastirici radyasyonla molekullerin ayrismasi Termal bozunmaKaynakca a b Atkins P and de Paula J Physical Chemistry 8th ed W H Freeman 2006 p 763 978 0 7167 8759 4 a b General chemistry principles and modern applications 8th Upper Saddle River N J Prentice Hall 2002 ISBN 978 0 13 014329 7 OCLC 46872308 Physical Chemistry with Biological Applications Benjamin Cummings 1978 p 307 978 0 8053 5680 9
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans







