Reaksiyon kinetiği olarak da bilinen kimyasal kinetik, kimyasal reaksiyonların hızlarını ve mekanizmalarını araştırmakla ilgilenen bir fiziksel kimya dalıdır. Bir sürecin gerçekleştiği yön ile ilgilenen ancak gerçekleşme hızları hakkında bir bilgi vermeyen termodinamik ile karıştırılmamalıdır. Kimyasal kinetik, deneysel koşulların kimyasal reaksiyonların hızı üzerine etkilerini, reaksiyon mekanizmaları ile verim bilgilerini ve kimyasal reaksiyonların karakteristiklerini tanımlayan matematiksel modellerin çıkarılmasını kapsayan bir bilim alanıdır.
Tarihçe
1864'te Peter Waage ve , kimyasal reaksiyon hızının reaksiyona giren maddelerin miktarıyla orantılı olduğunu belirten formüle ederek kimyasal kinetiklerin geliştirilmesine öncülük ettiler.
Van 't Hoff kimyasal dinamik üzerine çalışmalar gerçekleştirmiş ve 1884'te ünlü "Études de dynamique chimique" (Dinamik Kimya Alanında Çalışmalar) adlı kitabını yayınlamıştır. 1901'de "kimyasal dinamik ve çözeltilerde ozmotik basınç kanunlarının keşfi ile sağladığı müstesna hizmetler karşılığında" ilk Nobel Kimya Ödülü'nü almıştır. Kimyasal kinetik, van 't Hoff'tan sonra ve türetildiği reaksiyon hızlarının deneysel olarak belirlenmesi ile ilgilenmiştir. Sıfır mertebeli reaksiyonlar (hızın derişime bağlı olarak değişim göstermediği reaksiyonlar), birinci dereceden reaksiyonlar ve ikinci dereceden reaksiyonlar için görece basit hız denklemleri mevcuttur. Diğer reaksiyonlar için de bu denklemler türetilebilir. kütle etki yasasına uyar ancak kademeli reaksiyonlar için çeşitli reaksiyon adımlarının hız denklemleri birleştirilmelidir ve bu oldukça karmaşık bir hâl alabilir. ise kimyasal kinetiği belirler. Birinci dereceden ardışık reaksiyonlar için yaklaşımı yapmak hız denklemini basitleştirebilir. Bir reaksiyon için gereken aktivasyon enerjisi ve denklemi üzerinden deneysel olarak belirlenir. Tepkimeye giren maddelerin fiziksel hâlleri ve derişimleri, reaksiyonda bir katalizör bulunup bulunmadığı ve reaksiyonun gerçekleştiği sıcaklık, reaksiyon hızını etkileyen başlıca unsurlardır.
ve Yablonsky, kimyasal dinamik tarihinin üç döneme ayrılabileceğini öne sürmüştür. İlki kimyasal reaksiyonların genel yasalarını araştıran ve kinetiği termodinamikle ilişkilendiren van 't Hoff akımıdır. İkincisi de özellikle için tepkime mekanizmalarının önemine vurgu yapan Semyonov-Hinshelwood akımı olarak düşünülebilir. Üçüncüsü ise 'in kimyasal reaksiyon ağlarının ayrıntılı matematiksel açıklamaları ile ilişkilendirilir.
Reaksiyon hızını etkileyen unsurlar
Tepkimeye giren maddelerin doğası
Reaksiyon hızı tepkimeye giren madde (reaktan olarak da adlandırılır) çeşidine göre değişkenlik gösterir. Asit-baz tepkimeleri, tuz oluşumu ve genelde hızlı gerçekleşen tepkimelerdir. Büyük moleküller oluştuğunda ve moleküller arasında kovalent bağ oluşumu gerçekleştiğinde, tepkimeler genelde yavaşlama eğilimi gösterir.
Tepkimeye giren moleküllerin doğası ve barındırdıkları bağların gücü, reaksiyon hızını önemli ölçüde etkiler.
Fiziksel hâl
Bir reaktanın fiziksel hâli de (katı, sıvı veya gaz) tepkime hızını etkileyen önemli bir unsurdur. Reaktanlar sulu çözeltilerde olduğu gibi aynı fazdayken termal hareket ile birbirlerine yaklaşırlar. Ancak farklı fazlarda bulunuyorlarsa, tepkime reaktanlar arası yüzeyde gerçekleşir. Reaksiyon sadece temas ettikleri bölge ile sınırlı kalır. Örneğin biri sıvı ve biri de gaz hâldeki iki maddenin tepkimeye girmesi durumunda, tepkime yalnızca sıvı yüzeyinde gerçekleşir. Tepkimenin tamamlanması için iyice çalkalamak ve karıştırmak gerekebilir. Bu durum, bir katı veya sıvı reaktan ne kadar iyi ayrışmışsa, birim hacme düşen yüzey alanının ve reaktanların birbiriyle temasının aynı oranda artacağı ve bu sayede reaksiyonun hızlanacağı anlamına gelir. Bir benzerlik kurmak adına şu örnek verilebilir: Ateş yakmak isteyen biri, büyük odun parçaları yerine çok daha ufak dallar ve çıra kullanarak başlayacaktır. Organik kimyada, , homojen reaksiyonların heterojen reaksiyonlardan (çözünen ve çözücünün uygun şekilde karışmadığı reaksiyonlar) daha hızlı gerçekleştiği kuralına bir istisnadır.
Yüzey alanı ve katı hâl
Katı bir maddede yalnızca yüzeyde bulunan partiküller reaksiyona girebilir. Bir katıyı daha küçük parçalara ayırmak, yüzeyde daha fazla partikül oluşmasını sağlayarak bu partiküller ile diğer reaktan partiküller arasındaki çarpışma sıklığını arttırmak suretiyle reaksiyonun çok daha hızlı gerçekleşmesine neden olacaktır. Örneğin , ince toz hâlinde malik asit (oldukça zayıf bir asit çeşidi) ve sodyum bikarbonat karışımından meydana gelir. Ağızdaki tükürük ile temas ettiğinde, bu kimyasallar hızla çözülür ve reaksiyona girerler. Reaksiyondan ortaya çıkan karbondioksit gazlı içeceklerin verdiği hissi sağlar. Ayrıca havai fişek üreticileri, havai fişeklerdeki yakıtın oksitlenme (yanma) hızını kontrol etmek için katı reaktanların yüzey alanını değiştirir ve bunu çeşitli efektler oluşturmak için kullanırlar. Örneğin, bir havai fişeğin içinde bulunan küçük parçalara bölünmüş alüminyum şiddetli bir şekilde patlar. Daha büyük alüminyum parçaları kullanılırsa, reaksiyon yavaşlar ve yanan metal parçaları çıkarıldıkça kıvılcımlar görülür.
Derişim (konsantrasyon)
Reaksiyonlar tepkimeye giren madde türlerinin çarpışması ile gerçekleşir. Molekül veya iyonların çarpışma sıklığı derişimlerine bağlıdır. Moleküller ne kadar çoksa, birbirlerine çarpıp tepkimeye girme olasılığı da o kadar fazla olur. Dolayısıyla, reaktanların derişimindeki bir artış genellikle reaksiyon hızında artışa neden olurken, derişimdeki bir azalmanın genellikle tam tersine yavaşlatıcı bir etkisi olacaktır. Örneğin yanma tepkimesi saf oksijen bulunan bir ortamda havaya göre (havanın yaklaşık %21'i oksijendir) daha hızlı gerçekleşir.
Hız denklemi, reaksiyon hızının mevcut reaktanların ve diğer türlerin derişimleriyle ilişkisini detaylı olarak gösterir. Matematiksel biçimler reaksiyon mekanizmasına bağlıdır. Belli bir reaksiyon için gerçek hız denklemi deneysel olarak belirlenir ve reaksiyon mekanizması hakkında bilgi verir. Hız denkleminin matematiksel ifadesi şu şekilde gösterilir:
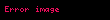
Burada 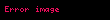

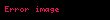

Sıcaklık
Sıcaklığın gerçekleşen tepkime üzerine genellikle büyük bir etkisi vardır. Yüksek sıcaklıkta bulunan moleküllerin termal enerjisi daha fazladır. Her ne kadar yüksek sıcaklıklarda çarpışma sıklığı daha fazla olsa da, bu durum reaksiyon hızındaki artışa esasında oldukça küçük bir katkıda bulunmaktadır. Bu konuda daha önem arz eden durum, reaksiyona girmek için yeterli enerjiye sahip (enerji büyüktür aktivasyon enerjisi: E > Ea) reaktan moleküllerin oranının önemli ölçüde daha yüksek olması ve moleküler enerjilerin Maxwell-Boltzmann dağılımı ile ayrıntılı olarak açıklanabilmesidir.
Sıcaklığın reaksiyon hızına etkisi genellikle 



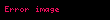
Belli bir sıcaklıkta kimyasal reaksiyon hızı A-faktörü, aktivasyon enerjisinin büyüklüğü ve reaktanların derişimine bağlıdır. Hızlı gerçekleşen reaksiyonlar genellikle düşük aktivasyon enerjisine sahiptirler.
Hızlı reaksiyonların kinetiği ile araştırılabilir. Bu metotta sıcaklıkta keskin bir artış kullanılarak dengeye geri dönüş için geçen gözlemlenir. Bilhassa kullanışlı sıcaklık fırlayış cihazlarından biri de . Şok tüpleri bir gazın sıcaklığını 1000 dereceden yüksek sıcaklıklara hızla çıkarabilir.
Katalizörler

Katalizör bir reaksiyonun hızını değiştiren fakat sonrasında kimyasal olarak değişmeden kalan maddedir. Katalizörler reaksiyon hızını daha düşük bir aktivasyon enerjisine sahip yeni bir reaksiyon mekanizması oluşturarak arttırırlar. oluşan reaksiyon ürünü, söz konusu reaksiyon için pozitif geri beslemeye yol açan bir katalizör işlevi görür. Biyokimyasal reaksiyonlarda katalizör işlevi gören proteinlere enzim adı verilir. Enzim yoluyla gerçekleşen reaksiyonların hızı Michaelis-Menten kinetiği ile açıklanır. Katalizörler ileri ve geri yöndeki reaksiyonları eşit olarak hızlandırdığından kimyasal dengenin konumunu etkilemezler.
Bazı organik moleküllerde yer değiştiren özel gruplar, reaksiyon hızını etkileyebilir.
Basınç
Gaz hâlde gerçekleşen bir reaksiyonda basıncı artırmak reaktanların birbirleriyle çarpışma oranını artırarak reaksiyon hızının artmasına neden olacaktır. Bunun sebebi bir gazın kısmi basıncıyla doğru orantılı olmasıdır. Bu durum reaksiyon üzerine bir çözeltinin derişiminin artırılmasına benzer bir etki gösterir.
Bu basit kütle etki yasası tesirine ek olarak hız katsayıları da basınç ile değişim gösterebilirler. Gaz karışımına bir inert (tepkimeye girmeyen) gaz eklenirse, hız katsayıları ve yüksek sıcaklıkta gerçekleşen gaz fazdaki birçok reaksiyonun ürünleri değişir. Bu etki üzerindeki değişimlere kimyasal aktivasyon adı verilir. Ekzotermik veya endotermik reaksiyonların ısı aktarımından daha hızlı gerçekleşerek tepkimeye giren moleküllerin termal olmayan enerji dağılımlarına (Boltzmann dağılımına aykırı dağılım) sahip olmasına neden olduğundan dolayı bu olay gerçekleşir. Basıncı arttırmak, reaksiyona giren moleküllerin ve sistemin geri kalanının ısı aktarım hızını arttırarak söz konusu etkinin azalmasını sağlar.
Yoğun fazların da hız katsayıları basınçtan etkilenebilir ancak iyon ve moleküller bu fazda pek sıkıştırılabilir olmadığından ölçülebilir bir etki gözlemleyebilmek için görece yüksek basınçlar uygulamak gerekir. Bu etki sıklıkla hücre tabanlı elmaslar kullanılarak araştırılır.
Bir reaksiyonun kinetiği yaklaşımıyla da anlaşılabilir. Bu yöntem ile basınçta hızlı değişiklikler yapıldıktan sonra kimyasal dengeye geri dönüşün ölçülür.
Işık emilimi (absorpsiyonu)
Bir kimyasal reaksiyon için gereken aktivasyon enerjisi, tepkimeye giren bir molekülün uygun dalga boyundaki ışığı absorplayarak uyarılmış duruma geçmesiyle sağlanabilir. Işık enerjisi tarafından başlatılan reaksiyonlar fotokimyanın konusudur. Bu reaksiyonların başlıca örneklerinden biri fotosentezdir.
Deneysel yöntemler

Reaksiyon hızlarının deneysel olarak belirlenmesi, reaktan veya ürün konsantrasyonlarının zamanla değişiminin ölçülmesi yoluyla gerçekleştirilir. Örnek olarak, bir reaktanın konsantrasyonu spektrofotometre cihazı ile sistemdeki başka hiçbir reaktan veya ürünün absorbe etmediği bir dalga boyundaki ışık yardımıyla ölçülebilir.
En az birkaç dakika süren reaksiyonlar için reaktanlar istenilen sıcaklıkta karıştırıldıktan sonra gözlem yapmaya başlamak mümkündür.
Hızlı reaksiyonlar
Daha hızlı reaksiyonlar için reaktanların karıştırılması ve belirli bir sıcaklığa getirilmesi için gereken süre, reaksiyonun yarı ömrüne benzer veya daha uzun olabilir. Hızlı reaksiyonları başlatmak için yavaş karıştırma adımı olmayan özel yöntemler şunlardır:
- yöntemleri karıştırma süresini bir milisaniyeye kadar düşürebilir. Ancak durgulu akım yöntemlerinin bazı kısıtlamaları vardır. Gazları veya çözeltileri karıştırmak için geçen sürenin durgulu akım yönteminde dikkate alınması gerekir. Yarılanma ömrü saniyenin yüzde birinin altındaysa bu yöntem uygun değildir.
- Önceden karıştırılmış ve başlangıçta dengede olan sistemlerin, sıcaklık fırlayışı ve basınç fırlayışı gibi yöntemlerinde hızlı ısıtma veya basınçsızlaştırma ile pertürbe edilerek kimyasal dengeden çıkması sağlanır. Dengeden uzaklaşan sistemin tekrar dengeye dönüşünün süresi ölçülür. Örneğin bu yöntem normal koşullar altında 1 μs veya daha düşük bir yarılanma ömrüne sahip
(sırasıya hidronyum ve hidroksit iyonları) nötralleşmesini incelemek için kullanılır.
- bir lazer atımı ile serbest radikaller gibi yüksek derecelerde uyarılmış kimyasal türler üretilir. Sonrasında bu türlerin reaksiyonları üzerinde çalışmalar gerçekleştirilir.
Kimyasal denge
Kimyasal kinetik bir kimyasal reaksiyonun hızı ile ilgilenirken, termodinamik bir reaksiyonun hangi ölçüde gerçekleşeceğini belirler. , ileri ve geri tepkime hızları birbirine eşit olduğu ( prensibi) ve reaktanlar ile ürünlerin derişimleri değişim göstermediği anda kimyasal dengeye ulaşılır. Bu durum örnek olarak azot ve hidrojenden amonyak üretilen Haber-Bosch sürecinde gözlemlenebilir. gibi salınım reaksiyonları, tepkimede kimyasal dengeye ulaşılmadan önce bileşen derişimlerinin uzun bir süre boyu salınım yapabileceğini göstermektedir.
Serbest enerji
Genel olarak incelendiğinde, kimyasal bir değişimin gerçekleşip gerçekleşmeyeceğini belirlerken, kimyasal kinetik bir reaksiyonun hangi hızda gerçekleşeceğini izah eder. Bir reaksiyon oldukça ekzotermik olsa ve büyük bir entropi değişimi gösterse dahi eğer çok yavaşsa pratikte gerçekleşmez. Bir reaktandan iki ürün elde edilirken eğer tepkime gibi özel koşullarda tutulmuyorsa bu iki üründen termodinamik olarak en kararlı ürün oluşur. Her biri farklı bir ürün oluşturan, karşılıklı olarak hızla dönüşen iki reaktan için ürün oranının belirlenmesinde ise uygulanır. yola çıkılarak bir tepkimenin reaksiyon hız sabitleri hakkında tahminlerde bulunmak mümkündür.
Reaktanlardan birine ait bir atomun, izotopu ile yer değiştirildiği zaman reaksiyon hızında oluşan farka adı verilir.
Kimyasal kinetik, kimya mühendisliğinde reaktörlerde ve ısı transferi hesabı, polimer kimyasında da hakkında bilgi sağlar. de çeşitli bilgiler sağlamaktadır.
Modeller ve uygulamalar
Reaksiyon kinetiğini tanımlayan matematiksel modeller, kimyagerlere ve kimya mühendislerine gıda bozulması, biyolojik sistemlerin kimyası, mikroorganizmaların üremesi ve stratosferik ozon bozulması gibi kimyasal süreçleri daha iyi anlamak ve tanımlamak için araçlar sağlamaktadır. Bu modeller aynı zamanda kimyasal reaktörlerin ürün verimini optimize etmek, ürünlerini daha verimli bir şekilde ayırmak ve çevreye zararlı yan ürünlerini ortadan kaldırmak için gerekli tasarım ve değiştirmelerde kullanılabilir. Örneğin, kinetik modeller ağır hidrokarbonların benzine ve gaza işleminde, ağır hidrokarbonlardan benzinin en yüksek verimle üretileceği sıcaklığı ve basıncı bulmak için kullanılabilir.
Kimyasal kinetik, eğri uydurma yönteminin ve adi diferansiyel denklem çözümlerinin (ODE çözümü) bir fonksiyonu halindeki özel paketleri modelleme yoluyla sık sık araştırılır ve doğrulanır.
Ayrıca bakınız
- Kimyasal hız sabitlerini deneysel verilere uydurmak için kullanılan Matlab’in araç çubuğu
- Kimyasal reaksiyon mühendisliği
- kimyasal kinetik modelleme paketi
- Patlama
Kaynakça
- ^ C.M. Guldberg and P. Waage,"Studies Concerning Affinity" Forhandlinger i Videnskabs-Selskabet i Christiania (1864), 35
- ^ P. Waage, "Experiments for Determining the Affinity Law" ,Forhandlinger i Videnskabs-Selskabet i Christiania, (1864) 92.
- ^ C.M. Guldberg, "Concerning the Laws of Chemical Affinity", Forhandlinger i Videnskabs-Selskabet i Christiania (1864) 111
- ^ Hoff, J. H. van't (Jacobus Henricus van't); Cohen, Ernst; Ewan, Thomas (1896-01-01). Studies in chemical dynamics. Amsterdam : F. Muller ; London : Williams & Norgate.
- ^ The Nobel Prize in Chemistry 1901 21 Temmuz 2018 tarihinde Wayback Machine sitesinde ., Nobel Prizes and Laureates, official website.
- ^ A.N. Gorban, G.S. Yablonsky Three Waves of Chemical Dynamics 29 Nisan 2021 tarihinde Wayback Machine sitesinde ., Mathematical Modelling of Natural Phenomena 10(5) (2015), p. 1–5.
- ^ Laidler, K. J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.42
- ^ a b c d Laidler, K. J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.33-39
- ^ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.254-256
- ^ a b Atkins P. and de Paula J., Physical Chemistry (8th ed., W.H. Freeman 2006) p.793
- ^ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.256-8
- ^ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1999) p.140-3
- ^ a b Atkins P. and de Paula J., Physical Chemistry (8th ed., W.H. Freeman 2006) pp.805-7
- ^ Laidler, K.J. Chemical Kinetics (3rd ed., Harper and Row 1987) p.359-360
- ^ Espenson, J.H. Chemical Kinetics and Reaction Mechanisms (2nd ed., McGraw-Hill 2002), p.264-6
- ^ Steinfeld J.I., Francisco J.S. and Hase W.L. Chemical Kinetics and Dynamics (2nd ed., Prentice-Hall 1999) p.94-97
- ^ "Chemical Kinetics: Simple Binding: F + G ⇋ B" (PDF) 14 Ocak 2020 tarihinde Wayback Machine sitesinde .. Civilized Software, Inc. Retrieved 2015-09-01.
Dış bağlantılar
- YouTube üzerinde LearnChemE tarafından yayınlanmış kimyasal reaksiyon mühendisliği dersleri 10 Ocak 2014 tarihinde Wayback Machine sitesinde .
- Kimya uygulamaları4 Haziran 2009 tarihinde Wayback Machine sitesinde .
- Gaz fazda gerçekleşen reaksiyonların kimyasal kinetiği 18 Ocak 2020 tarihinde Wayback Machine sitesinde .
- Kinpy: Kinetik denklemleri çözmek için Python kodu türeticisi 18 Ocak 2016 tarihinde Wayback Machine sitesinde .
- Reaksiyon hız kanunu ve reaksiyon profili – bir sıcaklık, derişim, çözelti ve katalizör sorusu – bir reaksiyon ne kadar hızlı ilerler 26 Eylül 2020 tarihinde Wayback Machine sitesinde . (SciFox’tan TIB AV – Portal’daki bir video)
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Reaksiyon kinetigi olarak da bilinen kimyasal kinetik kimyasal reaksiyonlarin hizlarini ve mekanizmalarini arastirmakla ilgilenen bir fiziksel kimya dalidir Bir surecin gerceklestigi yon ile ilgilenen ancak gerceklesme hizlari hakkinda bir bilgi vermeyen termodinamik ile karistirilmamalidir Kimyasal kinetik deneysel kosullarin kimyasal reaksiyonlarin hizi uzerine etkilerini reaksiyon mekanizmalari ile verim bilgilerini ve kimyasal reaksiyonlarin karakteristiklerini tanimlayan matematiksel modellerin cikarilmasini kapsayan bir bilim alanidir Tarihce1864 te Peter Waage ve kimyasal reaksiyon hizinin reaksiyona giren maddelerin miktariyla orantili oldugunu belirten formule ederek kimyasal kinetiklerin gelistirilmesine onculuk ettiler Van t Hoff kimyasal dinamik uzerine calismalar gerceklestirmis ve 1884 te unlu Etudes de dynamique chimique Dinamik Kimya Alaninda Calismalar adli kitabini yayinlamistir 1901 de kimyasal dinamik ve cozeltilerde ozmotik basinc kanunlarinin kesfi ile sagladigi mustesna hizmetler karsiliginda ilk Nobel Kimya Odulu nu almistir Kimyasal kinetik van t Hoff tan sonra ve turetildigi reaksiyon hizlarinin deneysel olarak belirlenmesi ile ilgilenmistir Sifir mertebeli reaksiyonlar hizin derisime bagli olarak degisim gostermedigi reaksiyonlar birinci dereceden reaksiyonlar ve ikinci dereceden reaksiyonlar icin gorece basit hiz denklemleri mevcuttur Diger reaksiyonlar icin de bu denklemler turetilebilir kutle etki yasasina uyar ancak kademeli reaksiyonlar icin cesitli reaksiyon adimlarinin hiz denklemleri birlestirilmelidir ve bu oldukca karmasik bir hal alabilir ise kimyasal kinetigi belirler Birinci dereceden ardisik reaksiyonlar icin yaklasimi yapmak hiz denklemini basitlestirebilir Bir reaksiyon icin gereken aktivasyon enerjisi ve denklemi uzerinden deneysel olarak belirlenir Tepkimeye giren maddelerin fiziksel halleri ve derisimleri reaksiyonda bir katalizor bulunup bulunmadigi ve reaksiyonun gerceklestigi sicaklik reaksiyon hizini etkileyen baslica unsurlardir ve Yablonsky kimyasal dinamik tarihinin uc doneme ayrilabilecegini one surmustur Ilki kimyasal reaksiyonlarin genel yasalarini arastiran ve kinetigi termodinamikle iliskilendiren van t Hoff akimidir Ikincisi de ozellikle icin tepkime mekanizmalarinin onemine vurgu yapan Semyonov Hinshelwood akimi olarak dusunulebilir Ucuncusu ise in kimyasal reaksiyon aglarinin ayrintili matematiksel aciklamalari ile iliskilendirilir Reaksiyon hizini etkileyen unsurlarTepkimeye giren maddelerin dogasi Reaksiyon hizi tepkimeye giren madde reaktan olarak da adlandirilir cesidine gore degiskenlik gosterir Asit baz tepkimeleri tuz olusumu ve genelde hizli gerceklesen tepkimelerdir Buyuk molekuller olustugunda ve molekuller arasinda kovalent bag olusumu gerceklestiginde tepkimeler genelde yavaslama egilimi gosterir Tepkimeye giren molekullerin dogasi ve barindirdiklari baglarin gucu reaksiyon hizini onemli olcude etkiler Fiziksel hal Bir reaktanin fiziksel hali de kati sivi veya gaz tepkime hizini etkileyen onemli bir unsurdur Reaktanlar sulu cozeltilerde oldugu gibi ayni fazdayken termal hareket ile birbirlerine yaklasirlar Ancak farkli fazlarda bulunuyorlarsa tepkime reaktanlar arasi yuzeyde gerceklesir Reaksiyon sadece temas ettikleri bolge ile sinirli kalir Ornegin biri sivi ve biri de gaz haldeki iki maddenin tepkimeye girmesi durumunda tepkime yalnizca sivi yuzeyinde gerceklesir Tepkimenin tamamlanmasi icin iyice calkalamak ve karistirmak gerekebilir Bu durum bir kati veya sivi reaktan ne kadar iyi ayrismissa birim hacme dusen yuzey alaninin ve reaktanlarin birbiriyle temasinin ayni oranda artacagi ve bu sayede reaksiyonun hizlanacagi anlamina gelir Bir benzerlik kurmak adina su ornek verilebilir Ates yakmak isteyen biri buyuk odun parcalari yerine cok daha ufak dallar ve cira kullanarak baslayacaktir Organik kimyada homojen reaksiyonlarin heterojen reaksiyonlardan cozunen ve cozucunun uygun sekilde karismadigi reaksiyonlar daha hizli gerceklestigi kuralina bir istisnadir Yuzey alani ve kati hal Kati bir maddede yalnizca yuzeyde bulunan partikuller reaksiyona girebilir Bir katiyi daha kucuk parcalara ayirmak yuzeyde daha fazla partikul olusmasini saglayarak bu partikuller ile diger reaktan partikuller arasindaki carpisma sikligini arttirmak suretiyle reaksiyonun cok daha hizli gerceklesmesine neden olacaktir Ornegin ince toz halinde malik asit oldukca zayif bir asit cesidi ve sodyum bikarbonat karisimindan meydana gelir Agizdaki tukuruk ile temas ettiginde bu kimyasallar hizla cozulur ve reaksiyona girerler Reaksiyondan ortaya cikan karbondioksit gazli iceceklerin verdigi hissi saglar Ayrica havai fisek ureticileri havai fiseklerdeki yakitin oksitlenme yanma hizini kontrol etmek icin kati reaktanlarin yuzey alanini degistirir ve bunu cesitli efektler olusturmak icin kullanirlar Ornegin bir havai fisegin icinde bulunan kucuk parcalara bolunmus aluminyum siddetli bir sekilde patlar Daha buyuk aluminyum parcalari kullanilirsa reaksiyon yavaslar ve yanan metal parcalari cikarildikca kivilcimlar gorulur Derisim konsantrasyon Reaksiyonlar tepkimeye giren madde turlerinin carpismasi ile gerceklesir Molekul veya iyonlarin carpisma sikligi derisimlerine baglidir Molekuller ne kadar coksa birbirlerine carpip tepkimeye girme olasiligi da o kadar fazla olur Dolayisiyla reaktanlarin derisimindeki bir artis genellikle reaksiyon hizinda artisa neden olurken derisimdeki bir azalmanin genellikle tam tersine yavaslatici bir etkisi olacaktir Ornegin yanma tepkimesi saf oksijen bulunan bir ortamda havaya gore havanin yaklasik 21 i oksijendir daha hizli gerceklesir Hiz denklemi reaksiyon hizinin mevcut reaktanlarin ve diger turlerin derisimleriyle iliskisini detayli olarak gosterir Matematiksel bicimler reaksiyon mekanizmasina baglidir Belli bir reaksiyon icin gercek hiz denklemi deneysel olarak belirlenir ve reaksiyon mekanizmasi hakkinda bilgi verir Hiz denkleminin matematiksel ifadesi su sekilde gosterilir y dcdt k i 1cimi displaystyle upsilon operatorname d c over operatorname d t k prod i 1 c i m i Burada k displaystyle k ci displaystyle c i i displaystyle i reaktaninin molar derisimi ve mi displaystyle m i ise gecerli reaktanin kismi reaksiyon sirasidir Bir reaktanin stokiyometrik katsayisi ile genel olarak belirlenemez sadece deneysel olarak belirlenebilir Sicaklik Sicakligin gerceklesen tepkime uzerine genellikle buyuk bir etkisi vardir Yuksek sicaklikta bulunan molekullerin termal enerjisi daha fazladir Her ne kadar yuksek sicakliklarda carpisma sikligi daha fazla olsa da bu durum reaksiyon hizindaki artisa esasinda oldukca kucuk bir katkida bulunmaktadir Bu konuda daha onem arz eden durum reaksiyona girmek icin yeterli enerjiye sahip enerji buyuktur aktivasyon enerjisi E gt Ea reaktan molekullerin oraninin onemli olcude daha yuksek olmasi ve molekuler enerjilerin Maxwell Boltzmann dagilimi ile ayrintili olarak aciklanabilmesidir Sicakligin reaksiyon hizina etkisi genellikle k Ae Ea RT displaystyle k Ae E rm a RT formulu ile gosterilen uymaktadir Burada A displaystyle A veya A faktoru Ea displaystyle E a aktivasyon enerjisi R displaystyle R ve T displaystyle T mutlak sicakliktir Belli bir sicaklikta kimyasal reaksiyon hizi A faktoru aktivasyon enerjisinin buyuklugu ve reaktanlarin derisimine baglidir Hizli gerceklesen reaksiyonlar genellikle dusuk aktivasyon enerjisine sahiptirler Hizli reaksiyonlarin kinetigi ile arastirilabilir Bu metotta sicaklikta keskin bir artis kullanilarak dengeye geri donus icin gecen gozlemlenir Bilhassa kullanisli sicaklik firlayis cihazlarindan biri de Sok tupleri bir gazin sicakligini 1000 dereceden yuksek sicakliklara hizla cikarabilir Katalizorler Bir katalizorun varsayimsal bir endotermik kimyasal reaksiyon uzerine etkisini gosteren grafik Katalizor varliginda daha dusuk bir aktivasyon enerjisine sahip bir reaksiyon yolu acilir kirmizi ile gosterilmistir Reaksiyon gerceklestiginde toplam sonuc ve entalpi farki degismez Katalizor bir reaksiyonun hizini degistiren fakat sonrasinda kimyasal olarak degismeden kalan maddedir Katalizorler reaksiyon hizini daha dusuk bir aktivasyon enerjisine sahip yeni bir reaksiyon mekanizmasi olusturarak arttirirlar olusan reaksiyon urunu soz konusu reaksiyon icin pozitif geri beslemeye yol acan bir katalizor islevi gorur Biyokimyasal reaksiyonlarda katalizor islevi goren proteinlere enzim adi verilir Enzim yoluyla gerceklesen reaksiyonlarin hizi Michaelis Menten kinetigi ile aciklanir Katalizorler ileri ve geri yondeki reaksiyonlari esit olarak hizlandirdigindan kimyasal dengenin konumunu etkilemezler Bazi organik molekullerde yer degistiren ozel gruplar reaksiyon hizini etkileyebilir Basinc Gaz halde gerceklesen bir reaksiyonda basinci artirmak reaktanlarin birbirleriyle carpisma oranini artirarak reaksiyon hizinin artmasina neden olacaktir Bunun sebebi bir gazin kismi basinciyla dogru orantili olmasidir Bu durum reaksiyon uzerine bir cozeltinin derisiminin artirilmasina benzer bir etki gosterir Bu basit kutle etki yasasi tesirine ek olarak hiz katsayilari da basinc ile degisim gosterebilirler Gaz karisimina bir inert tepkimeye girmeyen gaz eklenirse hiz katsayilari ve yuksek sicaklikta gerceklesen gaz fazdaki bircok reaksiyonun urunleri degisir Bu etki uzerindeki degisimlere kimyasal aktivasyon adi verilir Ekzotermik veya endotermik reaksiyonlarin isi aktarimindan daha hizli gercekleserek tepkimeye giren molekullerin termal olmayan enerji dagilimlarina Boltzmann dagilimina aykiri dagilim sahip olmasina neden oldugundan dolayi bu olay gerceklesir Basinci arttirmak reaksiyona giren molekullerin ve sistemin geri kalaninin isi aktarim hizini arttirarak soz konusu etkinin azalmasini saglar Yogun fazlarin da hiz katsayilari basinctan etkilenebilir ancak iyon ve molekuller bu fazda pek sikistirilabilir olmadigindan olculebilir bir etki gozlemleyebilmek icin gorece yuksek basinclar uygulamak gerekir Bu etki siklikla hucre tabanli elmaslar kullanilarak arastirilir Bir reaksiyonun kinetigi yaklasimiyla da anlasilabilir Bu yontem ile basincta hizli degisiklikler yapildiktan sonra kimyasal dengeye geri donusun olculur Isik emilimi absorpsiyonu Bir kimyasal reaksiyon icin gereken aktivasyon enerjisi tepkimeye giren bir molekulun uygun dalga boyundaki isigi absorplayarak uyarilmis duruma gecmesiyle saglanabilir Isik enerjisi tarafindan baslatilan reaksiyonlar fotokimyanin konusudur Bu reaksiyonlarin baslica orneklerinden biri fotosentezdir Deneysel yontemlerSpinco Division Model 260 Reaksiyon Kinetigi Sistemi molekuler reaksiyonlarin hiz sabitlerini yuksek hassasiyetle olcer Reaksiyon hizlarinin deneysel olarak belirlenmesi reaktan veya urun konsantrasyonlarinin zamanla degisiminin olculmesi yoluyla gerceklestirilir Ornek olarak bir reaktanin konsantrasyonu spektrofotometre cihazi ile sistemdeki baska hicbir reaktan veya urunun absorbe etmedigi bir dalga boyundaki isik yardimiyla olculebilir En az birkac dakika suren reaksiyonlar icin reaktanlar istenilen sicaklikta karistirildiktan sonra gozlem yapmaya baslamak mumkundur Hizli reaksiyonlar Daha hizli reaksiyonlar icin reaktanlarin karistirilmasi ve belirli bir sicakliga getirilmesi icin gereken sure reaksiyonun yari omrune benzer veya daha uzun olabilir Hizli reaksiyonlari baslatmak icin yavas karistirma adimi olmayan ozel yontemler sunlardir yontemleri karistirma suresini bir milisaniyeye kadar dusurebilir Ancak durgulu akim yontemlerinin bazi kisitlamalari vardir Gazlari veya cozeltileri karistirmak icin gecen surenin durgulu akim yonteminde dikkate alinmasi gerekir Yarilanma omru saniyenin yuzde birinin altindaysa bu yontem uygun degildir Onceden karistirilmis ve baslangicta dengede olan sistemlerin sicaklik firlayisi ve basinc firlayisi gibi yontemlerinde hizli isitma veya basincsizlastirma ile perturbe edilerek kimyasal dengeden cikmasi saglanir Dengeden uzaklasan sistemin tekrar dengeye donusunun suresi olculur Ornegin bu yontem normal kosullar altinda 1 ms veya daha dusuk bir yarilanma omrune sahip H3O OH displaystyle ce H3O OH sirasiya hidronyum ve hidroksit iyonlari notrallesmesini incelemek icin kullanilir bir lazer atimi ile serbest radikaller gibi yuksek derecelerde uyarilmis kimyasal turler uretilir Sonrasinda bu turlerin reaksiyonlari uzerinde calismalar gerceklestirilir Kimyasal dengeKimyasal kinetik bir kimyasal reaksiyonun hizi ile ilgilenirken termodinamik bir reaksiyonun hangi olcude gerceklesecegini belirler ileri ve geri tepkime hizlari birbirine esit oldugu prensibi ve reaktanlar ile urunlerin derisimleri degisim gostermedigi anda kimyasal dengeye ulasilir Bu durum ornek olarak azot ve hidrojenden amonyak uretilen Haber Bosch surecinde gozlemlenebilir gibi salinim reaksiyonlari tepkimede kimyasal dengeye ulasilmadan once bilesen derisimlerinin uzun bir sure boyu salinim yapabilecegini gostermektedir Serbest enerjiGenel olarak incelendiginde kimyasal bir degisimin gerceklesip gerceklesmeyecegini belirlerken kimyasal kinetik bir reaksiyonun hangi hizda gerceklesecegini izah eder Bir reaksiyon oldukca ekzotermik olsa ve buyuk bir entropi degisimi gosterse dahi eger cok yavassa pratikte gerceklesmez Bir reaktandan iki urun elde edilirken eger tepkime gibi ozel kosullarda tutulmuyorsa bu iki urunden termodinamik olarak en kararli urun olusur Her biri farkli bir urun olusturan karsilikli olarak hizla donusen iki reaktan icin urun oraninin belirlenmesinde ise uygulanir yola cikilarak bir tepkimenin reaksiyon hiz sabitleri hakkinda tahminlerde bulunmak mumkundur Reaktanlardan birine ait bir atomun izotopu ile yer degistirildigi zaman reaksiyon hizinda olusan farka adi verilir Kimyasal kinetik kimya muhendisliginde reaktorlerde ve isi transferi hesabi polimer kimyasinda da hakkinda bilgi saglar de cesitli bilgiler saglamaktadir Modeller ve uygulamalarReaksiyon kinetigini tanimlayan matematiksel modeller kimyagerlere ve kimya muhendislerine gida bozulmasi biyolojik sistemlerin kimyasi mikroorganizmalarin uremesi ve stratosferik ozon bozulmasi gibi kimyasal surecleri daha iyi anlamak ve tanimlamak icin araclar saglamaktadir Bu modeller ayni zamanda kimyasal reaktorlerin urun verimini optimize etmek urunlerini daha verimli bir sekilde ayirmak ve cevreye zararli yan urunlerini ortadan kaldirmak icin gerekli tasarim ve degistirmelerde kullanilabilir Ornegin kinetik modeller agir hidrokarbonlarin benzine ve gaza isleminde agir hidrokarbonlardan benzinin en yuksek verimle uretilecegi sicakligi ve basinci bulmak icin kullanilabilir Kimyasal kinetik egri uydurma yonteminin ve adi diferansiyel denklem cozumlerinin ODE cozumu bir fonksiyonu halindeki ozel paketleri modelleme yoluyla sik sik arastirilir ve dogrulanir Ayrica bakinizKimyasal hiz sabitlerini deneysel verilere uydurmak icin kullanilan Matlab in arac cubugu Kimyasal reaksiyon muhendisligi kimyasal kinetik modelleme paketi PatlamaKaynakca C M Guldberg and P Waage Studies Concerning Affinity Forhandlinger i Videnskabs Selskabet i Christiania 1864 35 P Waage Experiments for Determining the Affinity Law Forhandlinger i Videnskabs Selskabet i Christiania 1864 92 C M Guldberg Concerning the Laws of Chemical Affinity Forhandlinger i Videnskabs Selskabet i Christiania 1864 111 Hoff J H van t Jacobus Henricus van t Cohen Ernst Ewan Thomas 1896 01 01 Studies in chemical dynamics Amsterdam F Muller London Williams amp Norgate The Nobel Prize in Chemistry 1901 21 Temmuz 2018 tarihinde Wayback Machine sitesinde Nobel Prizes and Laureates official website A N Gorban G S Yablonsky Three Waves of Chemical Dynamics 29 Nisan 2021 tarihinde Wayback Machine sitesinde Mathematical Modelling of Natural Phenomena 10 5 2015 p 1 5 Laidler K J Chemical Kinetics 3rd ed Harper and Row 1987 p 42 ISBN 0 06 043862 2 a b c d Laidler K J Chemical Kinetics 3rd ed Harper and Row 1987 p 33 39 ISBN 0 06 043862 2 Espenson J H Chemical Kinetics and Reaction Mechanisms 2nd ed McGraw Hill 2002 p 254 256 ISBN 0 07 288362 6 a b Atkins P and de Paula J Physical Chemistry 8th ed W H Freeman 2006 p 793 ISBN 0 7167 8759 8 Espenson J H Chemical Kinetics and Reaction Mechanisms 2nd ed McGraw Hill 2002 p 256 8 ISBN 0 07 288362 6 Steinfeld J I Francisco J S and Hase W L Chemical Kinetics and Dynamics 2nd ed Prentice Hall 1999 p 140 3 ISBN 0 13 737123 3 a b Atkins P and de Paula J Physical Chemistry 8th ed W H Freeman 2006 pp 805 7 ISBN 0 7167 8759 8 Laidler K J Chemical Kinetics 3rd ed Harper and Row 1987 p 359 360 ISBN 0 06 043862 2 Espenson J H Chemical Kinetics and Reaction Mechanisms 2nd ed McGraw Hill 2002 p 264 6 ISBN 0 07 288362 6 Steinfeld J I Francisco J S and Hase W L Chemical Kinetics and Dynamics 2nd ed Prentice Hall 1999 p 94 97 ISBN 0 13 737123 3 Chemical Kinetics Simple Binding F G B PDF 14 Ocak 2020 tarihinde Wayback Machine sitesinde Civilized Software Inc Retrieved 2015 09 01 Dis baglantilarYouTube uzerinde LearnChemE tarafindan yayinlanmis kimyasal reaksiyon muhendisligi dersleri 10 Ocak 2014 tarihinde Wayback Machine sitesinde Kimya uygulamalari4 Haziran 2009 tarihinde Wayback Machine sitesinde Gaz fazda gerceklesen reaksiyonlarin kimyasal kinetigi 18 Ocak 2020 tarihinde Wayback Machine sitesinde Kinpy Kinetik denklemleri cozmek icin Python kodu tureticisi 18 Ocak 2016 tarihinde Wayback Machine sitesinde Reaksiyon hiz kanunu ve reaksiyon profili bir sicaklik derisim cozelti ve katalizor sorusu bir reaksiyon ne kadar hizli ilerler 26 Eylul 2020 tarihinde Wayback Machine sitesinde SciFox tan TIB AV Portal daki bir video
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans
