Elektrokimya, kimya biliminin bir alt dalı olup elektronik bir iletken (metal, grafit veya yarı iletken) ile iyonik bir iletken (elektrolit) arayüzeyinde gerçekleşen reaksiyonları inceler. Elektrokimyada amaç kimyasal enerji ve elektrik enerjisi arasındaki değişimi incelemektir.
Eğer harici bir voltaj uygulanarak bir kimyasal reaksiyon meydana getiriliyor veya, pilde olduğu gibi, bir kimyasal reaksiyon bir voltaja neden oluyorsa bu bir "elektrokimyasal reaksiyondur. Bir molekülden diğerine doğrudan yük taşınımı, elektrokimyanın konusu değildir.
Tarihçe
16. ile 18. yüzyıllar arasındaki gelişmeler
16. yüzyıl, elektriğin yavaş yavaş anlaşılmaya başlandığı yüzyıl olmuştur. Bu yüzyılda, İngiliz bilim insanı William Gilbert 17 yıl boyunca ağırlıklı olarak manyetizma ve elektrik üzerine çalışmış ve bu çalışmaları ona manyetizmanın babası unvanını kazandırmıştır. Gilbert, mıknatısların üretimi ve güçlendirilmesi üzerine farklı metotlar keşfetmiştir.
1663'te Alman fizikçi Otto von Guericke, sürtünme ile çalışarak statik elektrik üreten ilk elektrik jeneratörünü geliştirdi.
1700'lerin ortalarında, Fransız kimyacı Charles François de Cisternay du Fay, aynı yüklerin birbirini ittiği, zıt yüklerin birbirini çektiği iki farklı tür statik elektriğin varlığını keşfetti.
Charles-Augustin de Coulomb, 1781'de elektrostatik çekim kanununu geliştirdi. İtalyan doktor ve anatomi uzmanı Luigi Galvani, 1791'de yazdığı eserinde ("De Viribus Electricitatis in Motu Musculari Commentarius" (Latince: Elektriğin kas hareketlerine etkisi üzerine yorumlar)) kimyasal reaksiyonlar ve elektrik arasında bir köprü kurarak elektrokimyanın doğumunu belirledi.
1800'de, İngiliz kimyacılar William Nicholson ve , suyu elektroliz yoluyla hidrojen ve oksijene ayrıştırmayı başardılar. Kısa süre sonra Ritter, prosesini keşfetti ve elektrolitik bir proseste, kaplanan metal ile üretilen oksijen miktarının elektrotlar arasındaki mesafeye bağlı olduğunu gözlemledi.
1810 yılında, William Hyde Wollaston, daha da geliştirdi. Humphry Davy'nin elektroliz üzerine yaptığı çalışmalar, basit elektrolitik hücrelerde üretilen elektriğin, zıt yüklü maddeler arasındaki kimyasal reaksiyonun ve kimyasal bağlanmanın bir sonucu olduğunu gösterdi.
1820'de, Hans Christian Ørsted'in elektrik akımının manyetik etkisini keşfi, büyük çığır açan bir gelişmeydi. André-Marie Ampère, Ørsted'in deneylerini tekrarladı ve matematiksel olarak formüle etti.
1821'de, Estonyalı-Alman fizikçi iki farklı metalin ek yerlerinde ısı farkı olduğunda elektriksel bir potansiyel oluştuğunu gösterdi.
Alman bilim insanı Georg Ohm, 1827'de yayımladığı ünlü kitabı "Die galvanische Kette, mathematisch bearbeitet" (Galvanik devrenin matematiksel incelenmesi)'nde, günümüzde kendi adıyla bilinen Ohm kanunu'nu açıkladı.
Michael Faraday, gerçekleştirdiği elektrokimya deneylerinin sonuçlarını 1832 yılında ünlü iki kanunu ile açıkladı. 1836'da John Daniell elektrik üretirken hidrojen çıkarmayan hücresini keşfetti.


William Grove ilk yakıt hücresini 1839'da üretti. 1846'da Wilhelm Weber elektro-dinamometre'yi icat etti. 1866'da günümüzde tüm dünyada yaygın olarak kullanılan 'nin ilk öncüsü kabul edilebilecek hücrenin patentini aldı.
Svante August Arrhenius'un, 1884'te yayımladığı Recherches sur la conductibilité galvanique des électrolytes (Elektrolitlerin galvanik iletkenliği üzerine araştırmalar) adlı tezinin sonuçlarına göre, elektrolitler su içinde çözündüklerinde, değişen derecelerde ve elektriksel olarak zıt yüklü iyonlara ayrışıyorlardı.
1886'da Paul Héroult ve Charles M. Hall, Michael Faraday'ın tanımladığı prensiplerden yararlanarak aluminyum eldesine yönelik başarılı bir metot geliştirdiler.
1894'te Friedrich Ostwald, organik asitlerin elektriksel iletkenliği ve elektrolitik parçalanması üzerine yaptığı çalışmalarını tamamladı.
Walther Hermann Nernst 1888'de volta hücresinin elektromotor kuvvetinin teorisini geliştirdi. Ertesi yıl, üretilen akımın karakteristiklerinden yararlanarak, akımı üreten kimyasal reaksiyonun serbest enerjisinin nasıl hesaplanacağını açıklayan ve günümüzde Nernst denklemi olarak bilinen eşitliği oluşturdu.
1898'de Fritz Haber, elektrolitik proseslerde katot potansiyeli sabit tutulduğunda belirli redüksiyon ürünlerinin meydana gelebileceğini gösterdi.
20. yüzyıldaki ve yeni gelişmeler
- 1902'de kuruldu.
- 1909'da Robert Andrews Millikan, tek bir elektronun elektrik yükünü belirleme deneylerine başladı.
- 1923'te Johannes Nicolaus Brønsted ve , asit ve bazların nasıl davrandığına ilişkin teorilerini yayımladılar.
- Arne Tiselius, 1937'de ilk gelişmiş elektroforetik cihazı yaptı ve protein elektroforezi ile ilgili çalışmalarından ötürü 1948 yılında Nobel Ödülü'ne layık görüldü.
- 1949'da kuruldu.
- 1960 ve 1970'li yıllarda ve öğrencileri geliştirdiler.
Prensipler
Redoks reaksiyonları
Elektrokimyasal prosesler, kendiliğinden meydana gelen ve elektrik üreten kimyasal reaksiyonların veya bir elektrik akımının kimyasal bir reaksiyona yol açtığı proseslerdir. Bir redoks reaksiyonunda, bir atom veya iyonun oksidasyon derecesi (kısaca elektrik yükü) elektron aktarımı sonucu değişir.
Oksidasyon ve Redüksiyon
Bir yer alan elementler, sahip oldukları elektron sayısı ile karakterize edilirler. Bir iyonun oksidasyon seviyesi, nötr haline oranla aldığı veya verdiği elektron sayısıdır. Eğer bir atom veya iyon, bir reaksiyonda bir elektron verirse oksidasyon seviyesi yükselir ya da tam tersine, eğer elektron alırsa oksidasyon seviyesi düşer.
Örneğin, sodyum, klor ile reaksiyona girdiğinde bir elektron verir ve 1+ oksidasyon seviyesi kazanır. Klor da böylece bir elektron alarak 1- oksidasyon seviyesi kazanır. Oksidasyon seviyesinin işareti (+ veya - oluşu) her bir iyonun elektronik yüküne karşı gelir. Zıt elektrik yüklü sodyum ve klor iyonlarının birbirini çekmesi, iyonik bağ oluşturmalarının nedenidir.
Bir maddennin elektron vermesi oksidasyon, elektron kazanması ise redüksiyondur. Elektron veren bir madde redükleyici, elektron alan madde ise oksitleyici olarak bilinir. Oksitleyici madde reaksiyonda redüklenir, redükleyici madde ise oksitlenir.
Oksidasyon ve redüksiyonun aynı anda meydana geldiği reaksiyonlar redoks reaksiyonları olarak bilinir. Bu tür reaksiyonlarda maddelerden birisi elektron alırken diğeri elektron verir.
Oksidasyonda bir oksitleyiciye gereksinim vardır. Oksijen bir oksitleyicidir ama tek oksitleyici değildir. Adına rağmen, oksidasyon reaksiyonunda oksijenin bulunmasına gerek yoktur. Nitekim, bir ateş, oksijenden başka bir oksitleyici ile beslenebilir; örneğin flor yangınları genellikle kolay kolay söndürülemez, zira flor, oksijenden daha kuvvetli bir oksitleyicidir (elektronegatifliği oksijenden daha yüksektir).
Redoks reaksiyonlarının dengelenmesi
Sulu çözeltilerdeki elektrokimyasal reaksiyonlar, redoks reaksiyonlarının iyon-elektron metodu kullanılarak dengelenmesiyle daha iyi anlaşılabilir. Bu metotta, H+, OH- iyonları, H2O ve elektronlar (oksidasyon değişikliklerini kompanse etmek için) hücrenin yarı-reaksiyonlarına ilave edilirler.
Asidik ortam
Asidik ortamda, genel reaksiyonu dengelemek için yarı-reaksiyonlara H+ iyonları ve su ilave edilir. Örneğin, manganez ile reaksiyona girdiğinde;
Dengelenmemiş reaksiyon: 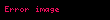
Oksidasyon: 
Redüksiyon: 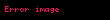
Nihayet reaksiyon, redüksiyon yarı-reaksiyonundaki elektron sayısı ile oksidasyon yarı-reaksiyonunu ve oksidasyon yarı-reaksiyonundaki elektron sayısı ile redüksiyon yarı-reaksiyonunu çarparak dengelenir.
ve dengelenmiş reaksiyon:
şeklinde gösterilebilir.
Alkali ortam
Alkali ortamda, genel reaksiyonu dengelemek için, yarı reaksiyonlara OH– iyonları ve su ilave edilir. Örneğin, potasyum permanganat ile sodyum sülfit arasındaki reaksiyonda:
Dengelenmemiş reaksiyon: 
Redüksiyon: 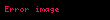
Oksidasyon: 
Asidik ortamdakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir.
Dengelenmiş denklem:
Nötr ortam
Asidik ortamda kullanılan metot izlenir. Örneğin, propan gazının tam yanma reaksiyonunun, elektron iyon metodu kullanılarak dengelenmesi gibi:
Dengelenmemiş reaksiyon: 
Redüksiyon: 
Oksidasyon: 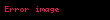
Asidik ve bazik ortamlardakine benzer şekilde, zıt yarı reaksiyonların elektron sayıları ile çarpılarak genel reaksiyon dengelenir.
Dengelenmiş denklem:
Elektrokimyasal hücreler
Bir elektrokimyasal hücre, kendiliğinden gelişen bir redoks reaksiyonunun ortaya çıkardığı enerjiden elektrik akımı üretebilen bir cihazdır. Bu tür bir hücre, Luigi Galvani ve Alessandro Volta'ya ithafen veya olarak da bilinir. Her iki bilim insanı, 18. yüzyılın sonlarında kimyasal reaksiyonlar ve elektrik akımı ile ilgili pek çok deney yapmışlardır.
Galvanik hücrede anot oksidasyonun, katot ise redüksiyonun gerçekleştiği elektrot olarak tanımlanır.
Galvanik hücredeki metaller, farklı yarı-hücre reaksiyonlarına göre çözündüğü için farklı çözünme hızlarına sahiptirler ve bu da her metal ile elektrolit arasında farklı bir elektrot potansiyeli oluşmasına neden olur. Eğer iki metal arasında elektriksel bir bağlantı (örneğin, bir tel ile) sağlanırsa, metaller arasında elektrik akışı gerçekleşir.
Elektrotları çinko ve bakır olan ve sırasıyla çinko sülfat ve bakır sülfat çözeltilerine daldırılmış bir elektrokimyasal hücre Daniell hücresi olarak bilinir.
Daniell hücresinde gerçekleşen yarı-reaksiyonlar şunlardır:
Çinko elektrotta (anot): 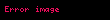
Bakır elektrotta (katot): 

Anot kompartmanında pozitif yüklerin birikmesini önlemek için, tuz köprüsü adı verilen ve bir elektrolit ile doldurulmuş bir ters çevrilerek hücreye yerleştirilir. Böylece iyonların akışı ve elektrik akımı üretimi sağlanmış olur.
Bir voltmetre vasıtasıyla, anot ve katot arasındaki potansiyel ölçülebilir. Elektrokimyasal hücre potansiyeli aynı zamanda elektromotor kuvvet veya emk olarak da adlandırılır.
Elektronların elektrokimyasal hücrede izlediği yolu belirtmek amacıyla bir hücre diyagramı çizilebilir. Örneğin Daniell hücresi için hücre diyagramı şu şekildedir:
Önce, anotta oksitlenen metalin (Zn) redüklenmiş formu yazılır. Bu form, oksitlenmiş formundan (Zn2+), fazlar arasındaki sınırı belirten düşey bir çizgi ile ayrılır. Çift düşey çizgi, hücredeki tuz köprüsünü simgeler. Nihayet, katotta redüklenen metalin oksitli formu ve yine bir düşey çizgi sonrasında da redüklenmiş formu yazılır.
Standart elektrot potansiyeli
Standart elektrot potansiyeli bir pildeki moleküler halde bulunan hidrojenin, standart basınç altında (105 Pa) çözünmüş protonlara dönüşmesiyle oluşan bir standart elektromotor kuvveti (emk) değeridir.
Hücre potansiyeli, yarı hücrelerin potansiyelleri arasındaki farka bağlıdır. Geleneksel olarak, her bir elektrodun potansiyeli, seçilen elektrot üzerinde gerçekleşen redüksiyon olarak yazılır. Dolayısıyla, standart elektrot potansiyelleri redüksiyon potansiyelleri olarak tablolaştırılmıştır ve 
Standart hücre potansiyeli, her bir elektrodun standart redüksiyon potansiyeli arasındaki fark olarak hesaplanır.
Yarı hücre standart redüksiyon potansiyelini ölçmek imkânsız olduğundan, 
Standart hidrojen elektrodu veya (SHE) laboratuvar tüplerine benzer ters çevrilmiş bir cam tüpten oluşur.Bu cam tüpte,ince ve hafif olan platin tel yine ince bir platin blade'e bağlanmıştır.Bu düzenek,H+ iyonlarının fazla bulunduğu hidroklorik asit çözelttisine yerleştirilmiştir.Gaz hidrojen tüpün içine girer, ilerlerken platin ile tepkime verir.Böylece yükseltgenme ve indigenme prosesleri gerçekleşmesine olanak sağlanır.
, Daniells pilindeki elektrotlar ile tam anlamıyla aynı şekilde çalışır.Standart indirgenme potansiyelini ölçmek için SHE,elektrokimyasal bir pilde elektrodlardan birini oluşturarak katot veya anot olarak görev yapar.Böylece pilde üretilen elektrik akımı ölçülmek istenen türün standart indirgenme potansiyelini gösterir.
Örneğin, bakırda standart indirgenme potansiyeli:
Standart basınç ve sıcaklıkta pilin emk'si 0.34 V'dur. Sonuç olarak sıfır değerini alır. Böylece önceki eşitlik düzenlendiğinde aşağıdaki sonuç çıkar:
Elektrokimyasal hücrelerde emk, oluşan redoks reaksiyonunun kendiliğinden bir proses olup olmadığını tahmin etmeye yarar. Toplam hücre standart potansiyelinin pozitif bir değer olması, tepkimenin kendiliğinden olduğunu gösterir. Negatif bir değer de ters yönde kendiliğinden bir tepkime olduğunu işaret eder.
Dengedeki bir hücrenin reaksiyon denklemindeki değişmesi 
Redoks sistemlerinin kendiliğinden meydana gelişi
Elektrokimyasal pillerde kimyasal enerji, dönüşür. Matematiksel olarak bu dönüşüm pilin elektromotor kuvveti ile elektriksel yükün çarpımı olarak gösterilir. Sonucunun birimi coulombdur.
Elektrokimyasal pilin toplam yükü, mol sayısı ile Faraday sabitinin (F) çarpılması ile bulunur.
Faraday sabiti, 1 mol elektronun toplam elektriksel yüküdür. Deneysel olarak 96485,3 coulomb olarak ölçülmüştür.
Pilin elektromotor kuvveti maksimum voltaj üretildiğinde ölçülür. Kimyasal reaksiyon'dan elde edilen en fazla elektrik enerjisini hesaplamak için bu değer kullanılır. Bu enerjiye denir ve aşağıdaki eşitlikle gösterilir.
Böylece serbest enerji,sistemden ayrılabilen mekanik işin bir büyüklüğüdür. Bu değeri önceki eşitlikte yerine koyduğumuzda 
Gibbs serbest enerjisi ve maksimum elektriksel iş arasındaki ilişki (standart sıcaklık ve basınç altında) sayesinde sistemin kendiliğinden bir proses olup olmadığı tahmin edilebilir.
Kendiliğinden oluşan elektrokimyasal bir reaksiyon,elektrokimyasal pillerde elektrik akımı üretmek için kullanılabilir. Bu, bütün pillerde ve yakıt pillerinde temel çalışma prensibidir. Örneğin, yakıt pillerinde oksijen gazının (O2 ve hidrojen gazının (H2) birleşmesi ile su,ısı ve elektriksel enerji açığa çıkar.
Karşıt olarak, kendiliğinden olmayan elektrokimyasal reaksiyonların, yeterli voltaj uygulanarak ileri yönde gitmesi sağlanabilir. Suyun oksijen ve hidrojen gazlarına elektrolizi buna tipik bir örnektir.
Denge sabiti ve kendiliğindenlik, elektrokimyasal hücrelerde Gibbs serbest enerjisi terimleri ile aşağıdaki gibi açıklanabilir.
İki eşitliğin çözülmesi ile pilin denge sabiti ve standart potansiyeli arasındaki ilişki gösterilebilir.
Önceki eşitlik şeklinde gösterilebilir:
Hücre emf'sinin konsantrasyona olan bağımlılığı
Nernst Denklemi
Bir pil potansiyelinin hesaplanması her zaman standart sıcaklık ve basınç altında mümkün olmaz.Fakat 1900'lü yıllarda Alman kimyager Walther Hermann Nernst standart koşulların sağlanmadığı durumlarda da kullanılabilecek bir matematiksel formül önerdi.
1800'lü yılların ortalarında her koşulda işe yarayan, kendiliğinde olan prosesler için bir denklem önerdi.
,
Burada;
ΔG = ndeki değişim, T = mutlak sıcaklık, R = , ln = doğal logaritma, Q = .
Wiillard Gibbs Q'nun reaktantların ve oluşan ürünlerin bağlı olduğunu belirtmiştir.
Walther 19. yüzyılın ortalarında Williard Gibbs'in çalışmalarından yola çıkarak,
Burada:
n =elektron sayısı/Mol ürün, F = Faraday sabiti (coulomb/Mol), and ΔE = .
Son olarak 
Standat koşullar kabul edildiğinde (
Konsantrasyon hücreleri
Konsantrasyon hücreleri elektrokimyasal hücrelerdir.Elektrodları aynı maddelerden yapılmış olsa da,her iki hücrede de iyonik derişimler farklıdır. Örneğin iki bakır elektrodun, 0.05 M ve 2 M'lık iki ayrı mavi vitriol çözeltisine daldırıldğı ve bunların tel ve tuz köprüsü ile bağlandığı bir sistem konsantrasyon tipi bir hücredir.
'ne göre 
Yarı reaksiyonlar da,
Hücrenin emk'sı da aşağıdaki Nernst denklemi ile hesaplanır:
Elektrotların ve iyonların buradaki gibi yarı hücrelerde aynı olduğu bu tür pillerde 
Fakat genellikle bu sonuç derişimler arasındaki orana değil de iyonların aktivitelerinin oranına bağlıdır.
Konsantrasyon hücreleri biyolojik araştırmalar için sık sık kullanılmaktadır.Burada membran potansiyelleri, sinir sinapslarına ve kalp atışlarına duyarlıdır.
Pil
Bir pil,doğru akım veya sabit voltaj üretebilen bir veya birden fazla elektrokimyasal hücre içerebilen sistemdir. Elektrokimya kuralları, elektrokimyasal hücrelerdeki gibi pillerde de geçerlidir.Hücreler ile arasındaki farklılık,pillerin tuz köprüsü gibi yardımcı öğelere ihtiyacının olmamasıdır. Pil kapalı sistemdir. Enerji alışverişi gerçekleştilir.
Kuru pil

Kuru pillerde sıvı elektrolit bulunmaz. Bunun yerine nemli bir elektrolit pasta içerirler. pilleri buna iyi bir örnektir. Bu tür hücrelerde anot, ince bir tabakası ile çevrili bir bakır barındırıcıdır. Mangan dioksit tabakası ile beraber bakırı çevreleyen amonyum klorür, ve nişasta karışımı da bulunur. Bu karışım pilin sabit durmasını ve sızıntı yapmamasını sağlar. Katot genellikle ortada yer alan, karbon bir çubuğun elektrolit çözeltisine daldırılmasıyla oluşan kısımdır.
yarı reaksiyonları aşağıdaki gibi birleştirmiştir:
:
genellikle 1.5 V civarında bir voltaj elde edilir.
Cıvalı pil
Cıvalı piller, tıpta ve elektronikte birçok uygulama alanı bulurlar. Pil, çelikten yapılmış silindir şeklinde katot görevi gören bir barındırıcı içerir. Anot bölümü de cıva ve çinko amalgamından oluşan, etrafı alkali bir elektrolit, çinko oksit pastası ve karışımından oluşan bir madde ile sarılmıştır.
Cıva pili yarı reaksiyonları aşağıda gösterilmiştir:
:
Pil çalışırken elektrolit içeriğinde bir değişiklik olmaz. Cıva pilleri 1,35 V'luk bir doğru akım üretir.
Kurşun asit pili
Kurşun asit pilleri sıralı altı adet hücre içerir ve otomobillerde kullanılırlar. Bu tür pillerde her hücrenin anodu kurşundan yapılmıştır. Katot kısmı da bir metal levha üzerine oturtulmuş kurşun dioksitten yapılmıştır. Katot ve anot, elektrolit görevi yapan sülfürik asit çözeltisine daldırılmıştır.
Kurşun asit pillerindeki yarı tepkimeler aşağıda gösterilmiştir:
Standart koşullarda, her hücre 2V'luk doğru akım üretebilir. Böylece toplam 12 V'luk bir voltaj üretilmiş olur. Cıva ve çinko-karbon pillerinden farklı olarak, kurşun asit pilleri tekrar şarj edilebilirdirler. Eğer pile dışarıdan bir voltaj uygulanırsa, toplam reaksiyonda ürünlerin elektrolizi olur (deşarj). Bunun sonucunda pilin çalışmasını sağlayan maddeler yenilenir.
Katı hal Lityum pili
Katı hal pilinde, sulu bir elektrolit veya nemli elektrolit pastası yerine katı elektrolit kullanılır. Bu pillere örnek olarak katı hal lityum pilleri verilebilir, ki burada katı haldeki bir lityum çubuk anot, bir veya çubuk katot ve iyonların geçişine izin verip elektronların geçişine izin vermeyen bir polimer de elektrolit vazifesi görür. Bu pillerin avantajı, lityumun en yüksek negatif standart redüksiyon potansiyeline sahip olmasıdır. Lityumun aynı zamanda bir hafif metal olması sayesinde de daha az kütleyle 1 mol elektron üretmek mümkün olur. Bu piller yeniden doldurulabilen türden olmayıp 3 Volt gerilim altında doğru akım üretirler.
Akışlı pil
Hemen hemen tüm pillerde elektrotlar ve elektrolit tek bir kap içerisindedir. Akışlı pilde ise alışılagelmişin tersine, elektrolitin büyük kısmı (çözünmüş reaktifler de dahil olmak üzere) farklı kaplarda saklanırlar. Elektrolitler, elektrotları bulunduran bir reaktör vasıtasıyla pompalanır. Bu tür piller genellikle büyük ölçekli enerji depolamada kullanılırlar (kWh, hatta birkaç MWh gibi). Geliştirilmiş pek çok çeşidi arasında, ticari öneme sahip olanlar vanadyum redoks pili ve çinko bromür pilidir.
Yakıt hücreleri
güç santrallerinde elektrik ihtiyacını karşılamak için kullanılır. Fakat elektriğe dönüştürme işlemleri,yeterince etkili bir proses değildir.En etkili elektrik santralleri bile %40 oranında, kimyasal enerjiyi elektrik enerjisine dönüştürmektedir.
Elektrik üretimini artırmak için,bilim adamları, elektrokimyasal metodlarla yanma reaksiyonlarının oluştuğu yakıt hücreleri geliştirmişlerdir.Böylece ihtiyaç duyulan reaktantların tüketildikten sonra tekrar elde edilmesi sağlanmaktadır.
Bunlardan en önemli olanı oksijen-hidrojen yakıt pilleridir. Bu pillerde iki ve nikel veya nikel oksit'den oluşan delikli bir elektrod bir (örneğin kostik potas) yerleştirilmiştir. Anod ve katod bölmelerinden de hidrojen ve oksijen gazı baloncuklar çıkartarak elektrolite karışır.
Oksijen-hidrojen yakıt pili reaksiyonları aşağıda gösterilmiştir:
Toplam reaksiyon hidrojen yanmasına benzerdir.Yükseltgenme ve indirgenme anot ve katotda ayrı ayrı yer alır. Bu, hücrede standart indirgenme potansiyeli ölçen elektroda benzer. Elektrod hm moleküllerin bozunması için yüzey oluşturur hem de elektriksel yalıtkan olarak görev yapar.Bu işlemler elektron aktarımından önce olduğundan dolayı adını da alır.Platin, nikel, rodyum iyi elektrokatlistlerdir.
Kaynakça
Dış bağlantılar
- Electrochemistry net 5 Nisan 2013 tarihinde Wayback Machine sitesinde .
- The Electrochemical Society 14 Ekim 2019 tarihinde Wayback Machine sitesinde .
- International Society of Electrochemistry (ISE) 27 Ağustos 2019 tarihinde Wayback Machine sitesinde .
- Electrochemistry Dictionary at Case Western Reserve University (size ~ 388KB)
- Experiments in Electrochemistry at Fun Science 12 Şubat 2009 tarihinde Wayback Machine sitesinde .
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Elektrokimya kimya biliminin bir alt dali olup elektronik bir iletken metal grafit veya yari iletken ile iyonik bir iletken elektrolit arayuzeyinde gerceklesen reaksiyonlari inceler Elektrokimyada amac kimyasal enerji ve elektrik enerjisi arasindaki degisimi incelemektir Eger harici bir voltaj uygulanarak bir kimyasal reaksiyon meydana getiriliyor veya pilde oldugu gibi bir kimyasal reaksiyon bir voltaja neden oluyorsa bu bir elektrokimyasal reaksiyondur Bir molekulden digerine dogrudan yuk tasinimi elektrokimyanin konusu degildir Tarihce16 ile 18 yuzyillar arasindaki gelismeler 16 yuzyil elektrigin yavas yavas anlasilmaya baslandigi yuzyil olmustur Bu yuzyilda Ingiliz bilim insani William Gilbert 17 yil boyunca agirlikli olarak manyetizma ve elektrik uzerine calismis ve bu calismalari ona manyetizmanin babasi unvanini kazandirmistir Gilbert miknatislarin uretimi ve guclendirilmesi uzerine farkli metotlar kesfetmistir 1663 te Alman fizikci Otto von Guericke surtunme ile calisarak statik elektrik ureten ilk elektrik jeneratorunu gelistirdi 1700 lerin ortalarinda Fransiz kimyaci Charles Francois de Cisternay du Fay ayni yuklerin birbirini ittigi zit yuklerin birbirini cektigi iki farkli tur statik elektrigin varligini kesfetti Charles Augustin de Coulomb 1781 de elektrostatik cekim kanununu gelistirdi Italyan doktor ve anatomi uzmani Luigi Galvani 1791 de yazdigi eserinde De Viribus Electricitatis in Motu Musculari Commentarius Latince Elektrigin kas hareketlerine etkisi uzerine yorumlar kimyasal reaksiyonlar ve elektrik arasinda bir kopru kurarak elektrokimyanin dogumunu belirledi 19 yuzyil 1800 de Ingiliz kimyacilar William Nicholson ve suyu elektroliz yoluyla hidrojen ve oksijene ayristirmayi basardilar Kisa sure sonra Ritter prosesini kesfetti ve elektrolitik bir proseste kaplanan metal ile uretilen oksijen miktarinin elektrotlar arasindaki mesafeye bagli oldugunu gozlemledi 1810 yilinda William Hyde Wollaston daha da gelistirdi Humphry Davy nin elektroliz uzerine yaptigi calismalar basit elektrolitik hucrelerde uretilen elektrigin zit yuklu maddeler arasindaki kimyasal reaksiyonun ve kimyasal baglanmanin bir sonucu oldugunu gosterdi 1820 de Hans Christian Orsted in elektrik akiminin manyetik etkisini kesfi buyuk cigir acan bir gelismeydi Andre Marie Ampere Orsted in deneylerini tekrarladi ve matematiksel olarak formule etti 1821 de Estonyali Alman fizikci iki farkli metalin ek yerlerinde isi farki oldugunda elektriksel bir potansiyel olustugunu gosterdi Alman bilim insani Georg Ohm 1827 de yayimladigi unlu kitabi Die galvanische Kette mathematisch bearbeitet Galvanik devrenin matematiksel incelenmesi nde gunumuzde kendi adiyla bilinen Ohm kanunu nu acikladi Michael Faraday gerceklestirdigi elektrokimya deneylerinin sonuclarini 1832 yilinda unlu iki kanunu ile acikladi 1836 da John Daniell elektrik uretirken hidrojen cikarmayan hucresini kesfetti Isvecli kimyaci Svante Arrhenius 1880 li yillar Alman bilim insani Walther Nernst 1910 lu yillar William Grove ilk yakit hucresini 1839 da uretti 1846 da Wilhelm Weber elektro dinamometre yi icat etti 1866 da gunumuzde tum dunyada yaygin olarak kullanilan nin ilk oncusu kabul edilebilecek hucrenin patentini aldi Svante August Arrhenius un 1884 te yayimladigi Recherches sur la conductibilite galvanique des electrolytes Elektrolitlerin galvanik iletkenligi uzerine arastirmalar adli tezinin sonuclarina gore elektrolitler su icinde cozunduklerinde degisen derecelerde ve elektriksel olarak zit yuklu iyonlara ayrisiyorlardi 1886 da Paul Heroult ve Charles M Hall Michael Faraday in tanimladigi prensiplerden yararlanarak aluminyum eldesine yonelik basarili bir metot gelistirdiler 1894 te Friedrich Ostwald organik asitlerin elektriksel iletkenligi ve elektrolitik parcalanmasi uzerine yaptigi calismalarini tamamladi Walther Hermann Nernst 1888 de volta hucresinin elektromotor kuvvetinin teorisini gelistirdi Ertesi yil uretilen akimin karakteristiklerinden yararlanarak akimi ureten kimyasal reaksiyonun serbest enerjisinin nasil hesaplanacagini aciklayan ve gunumuzde Nernst denklemi olarak bilinen esitligi olusturdu 1898 de Fritz Haber elektrolitik proseslerde katot potansiyeli sabit tutuldugunda belirli reduksiyon urunlerinin meydana gelebilecegini gosterdi 20 yuzyildaki ve yeni gelismeler 1902 de kuruldu 1909 da Robert Andrews Millikan tek bir elektronun elektrik yukunu belirleme deneylerine basladi 1923 te Johannes Nicolaus Bronsted ve asit ve bazlarin nasil davrandigina iliskin teorilerini yayimladilar Arne Tiselius 1937 de ilk gelismis elektroforetik cihazi yapti ve protein elektroforezi ile ilgili calismalarindan oturu 1948 yilinda Nobel Odulu ne layik goruldu 1949 da kuruldu 1960 ve 1970 li yillarda ve ogrencileri gelistirdiler PrensiplerRedoks reaksiyonlari Elektrokimyasal prosesler kendiliginden meydana gelen ve elektrik ureten kimyasal reaksiyonlarin veya bir elektrik akiminin kimyasal bir reaksiyona yol actigi proseslerdir Bir redoks reaksiyonunda bir atom veya iyonun oksidasyon derecesi kisaca elektrik yuku elektron aktarimi sonucu degisir Oksidasyon ve Reduksiyon Bir yer alan elementler sahip olduklari elektron sayisi ile karakterize edilirler Bir iyonun oksidasyon seviyesi notr haline oranla aldigi veya verdigi elektron sayisidir Eger bir atom veya iyon bir reaksiyonda bir elektron verirse oksidasyon seviyesi yukselir ya da tam tersine eger elektron alirsa oksidasyon seviyesi duser Ornegin sodyum klor ile reaksiyona girdiginde bir elektron verir ve 1 oksidasyon seviyesi kazanir Klor da boylece bir elektron alarak 1 oksidasyon seviyesi kazanir Oksidasyon seviyesinin isareti veya olusu her bir iyonun elektronik yukune karsi gelir Zit elektrik yuklu sodyum ve klor iyonlarinin birbirini cekmesi iyonik bag olusturmalarinin nedenidir Bir maddennin elektron vermesi oksidasyon elektron kazanmasi ise reduksiyondur Elektron veren bir madde redukleyici elektron alan madde ise oksitleyici olarak bilinir Oksitleyici madde reaksiyonda reduklenir redukleyici madde ise oksitlenir Oksidasyon ve reduksiyonun ayni anda meydana geldigi reaksiyonlar redoks reaksiyonlari olarak bilinir Bu tur reaksiyonlarda maddelerden birisi elektron alirken digeri elektron verir Oksidasyonda bir oksitleyiciye gereksinim vardir Oksijen bir oksitleyicidir ama tek oksitleyici degildir Adina ragmen oksidasyon reaksiyonunda oksijenin bulunmasina gerek yoktur Nitekim bir ates oksijenden baska bir oksitleyici ile beslenebilir ornegin flor yanginlari genellikle kolay kolay sondurulemez zira flor oksijenden daha kuvvetli bir oksitleyicidir elektronegatifligi oksijenden daha yuksektir Redoks reaksiyonlarinin dengelenmesi Sulu cozeltilerdeki elektrokimyasal reaksiyonlar redoks reaksiyonlarinin iyon elektron metodu kullanilarak dengelenmesiyle daha iyi anlasilabilir Bu metotta H OH iyonlari H2O ve elektronlar oksidasyon degisikliklerini kompanse etmek icin hucrenin yari reaksiyonlarina ilave edilirler Asidik ortam Asidik ortamda genel reaksiyonu dengelemek icin yari reaksiyonlara H iyonlari ve su ilave edilir Ornegin manganez ile reaksiyona girdiginde Dengelenmemis reaksiyon Mn2 aq NaBiO3 s Bi3 aq MnO4 aq displaystyle mbox Mn 2 aq mbox NaBiO 3 s rightarrow mbox Bi 3 aq mbox MnO 4 aq Oksidasyon 4H2O l Mn2 aq MnO4 aq 8H aq 5e displaystyle mbox 4H 2 mbox O l mbox Mn 2 aq rightarrow mbox MnO 4 aq mbox 8H aq mbox 5e Reduksiyon 2e 6H aq BiO3 s Bi3 aq 3H2O l displaystyle mbox 2e mbox 6H aq mbox BiO 3 s rightarrow mbox Bi 3 aq mbox 3H 2 mbox O l Nihayet reaksiyon reduksiyon yari reaksiyonundaki elektron sayisi ile oksidasyon yari reaksiyonunu ve oksidasyon yari reaksiyonundaki elektron sayisi ile reduksiyon yari reaksiyonunu carparak dengelenir 8H2O l 2Mn2 aq 2MnO4 aq 16H aq 10e displaystyle mbox 8H 2 mbox O l mbox 2Mn 2 aq rightarrow mbox 2MnO 4 aq mbox 16H aq mbox 10e 10e 30H aq 5BiO3 s 5Bi3 aq 15H2O l displaystyle mbox 10e mbox 30H aq mbox 5BiO 3 s rightarrow mbox 5Bi 3 aq mbox 15H 2 mbox O l ve dengelenmis reaksiyon 14H aq 2Mn2 aq 5NaBiO3 s 7H2O l 2MnO4 aq 5Bi3 aq 5Na aq displaystyle mbox 14H aq mbox 2Mn 2 aq mbox 5NaBiO 3 s rightarrow mbox 7H 2 mbox O l mbox 2MnO 4 aq mbox 5Bi 3 aq mbox 5Na aq seklinde gosterilebilir Alkali ortam Alkali ortamda genel reaksiyonu dengelemek icin yari reaksiyonlara OH iyonlari ve su ilave edilir Ornegin potasyum permanganat ile sodyum sulfit arasindaki reaksiyonda Dengelenmemis reaksiyon KMnO4 Na2SO3 H2O MnO2 Na2SO4 KOH displaystyle mbox KMnO 4 mbox Na 2 mbox SO 3 mbox H 2 mbox O rightarrow mbox MnO 2 mbox Na 2 mbox SO 4 mbox KOH Reduksiyon 23e 2H2O MnO4 MnO2 4OH displaystyle mbox 23e mbox 2H 2 mbox O mbox MnO 4 rightarrow mbox MnO 2 mbox 4OH Oksidasyon 2OH SO32 SO42 H2O 2e displaystyle mbox 2OH mbox SO 3 2 rightarrow mbox SO 4 2 mbox H 2 mbox O mbox 2e Asidik ortamdakine benzer sekilde zit yari reaksiyonlarin elektron sayilari ile carpilarak genel reaksiyon dengelenir 6e 4H2O 2MnO4 2MnO2 8OH displaystyle mbox 6e mbox 4H 2 mbox O mbox 2MnO 4 rightarrow mbox 2MnO 2 mbox 8OH 6OH 3SO32 3SO42 3H2O 6e displaystyle mbox 6OH mbox 3SO 3 2 rightarrow mbox 3SO 4 2 mbox 3H 2 mbox O mbox 6e Dengelenmis denklem 2KMnO4 3Na2SO3 H2O 2MnO2 3Na2SO4 2KOH displaystyle mbox 2KMnO 4 mbox 3Na 2 mbox SO 3 mbox H 2 mbox O rightarrow mbox 2MnO 2 mbox 3Na 2 mbox SO 4 mbox 2KOH Notr ortam Asidik ortamda kullanilan metot izlenir Ornegin propan gazinin tam yanma reaksiyonunun elektron iyon metodu kullanilarak dengelenmesi gibi Dengelenmemis reaksiyon C3H8 O2 CO2 H2O displaystyle mbox C 3 mbox H 8 mbox O 2 rightarrow mbox CO 2 mbox H 2 mbox O Reduksiyon 4H O2 4e H2O H2O displaystyle mbox 4H mbox O 2 mbox 4e rightarrow mbox H 2 mbox O mbox H 2 mbox O Oksidasyon 6H2O C3H8 3CO2 20e 20H displaystyle mbox 6H 2 mbox O mbox C 3 mbox H 8 rightarrow mbox 3CO 2 mbox 20e mbox 20H Asidik ve bazik ortamlardakine benzer sekilde zit yari reaksiyonlarin elektron sayilari ile carpilarak genel reaksiyon dengelenir 20H 5O2 20e 5H2O 5H2O displaystyle mbox 20H mbox 5O 2 mbox 20e rightarrow mbox 5H 2 mbox O mbox 5H 2 mbox O 6H2O C3H8 3CO2 20e 20H displaystyle mbox 6H 2 mbox O mbox C 3 mbox H 8 rightarrow mbox 3CO 2 mbox 20e mbox 20H Dengelenmis denklem C3H8 5O2 3CO2 4H2O displaystyle mbox C 3 mbox H 8 mbox 5O 2 rightarrow mbox 3CO 2 mbox 4H 2 mbox O Elektrokimyasal hucrelerBir elektrokimyasal hucre kendiliginden gelisen bir redoks reaksiyonunun ortaya cikardigi enerjiden elektrik akimi uretebilen bir cihazdir Bu tur bir hucre Luigi Galvani ve Alessandro Volta ya ithafen veya olarak da bilinir Her iki bilim insani 18 yuzyilin sonlarinda kimyasal reaksiyonlar ve elektrik akimi ile ilgili pek cok deney yapmislardir Galvanik hucrede anot oksidasyonun katot ise reduksiyonun gerceklestigi elektrot olarak tanimlanir Galvanik hucredeki metaller farkli yari hucre reaksiyonlarina gore cozundugu icin farkli cozunme hizlarina sahiptirler ve bu da her metal ile elektrolit arasinda farkli bir elektrot potansiyeli olusmasina neden olur Eger iki metal arasinda elektriksel bir baglanti ornegin bir tel ile saglanirsa metaller arasinda elektrik akisi gerceklesir Elektrotlari cinko ve bakir olan ve sirasiyla cinko sulfat ve bakir sulfat cozeltilerine daldirilmis bir elektrokimyasal hucre Daniell hucresi olarak bilinir Daniell hucresinde gerceklesen yari reaksiyonlar sunlardir Cinko elektrotta anot Zn s Zn2 aq 2e displaystyle mbox Zn s rightarrow mbox Zn 2 aq mbox 2e Bakir elektrotta katot Cu2 aq 2e Cu s displaystyle mbox Cu 2 aq mbox 2e rightarrow mbox Cu s Elektrokimya arastirmalarinda kullanilan modern bir hucre duzenegi Elektrotlar yuksek kaliteli tellere duzenek de resimde gorunmeyen bir a baglanmistir Kadeh seklindeki kap bir soy gazla havalandirilmakta olup sizdirmazligi teflon tabaka ile saglanmistir Anot kompartmaninda pozitif yuklerin birikmesini onlemek icin tuz koprusu adi verilen ve bir elektrolit ile doldurulmus bir ters cevrilerek hucreye yerlestirilir Boylece iyonlarin akisi ve elektrik akimi uretimi saglanmis olur Bir voltmetre vasitasiyla anot ve katot arasindaki potansiyel olculebilir Elektrokimyasal hucre potansiyeli ayni zamanda elektromotor kuvvet veya emk olarak da adlandirilir Elektronlarin elektrokimyasal hucrede izledigi yolu belirtmek amaciyla bir hucre diyagrami cizilebilir Ornegin Daniell hucresi icin hucre diyagrami su sekildedir Zn s Zn2 1M Cu2 1M Cu s displaystyle mbox Zn s mbox Zn 2 1M mbox Cu 2 1M mbox Cu s Once anotta oksitlenen metalin Zn reduklenmis formu yazilir Bu form oksitlenmis formundan Zn2 fazlar arasindaki siniri belirten dusey bir cizgi ile ayrilir Cift dusey cizgi hucredeki tuz koprusunu simgeler Nihayet katotta reduklenen metalin oksitli formu ve yine bir dusey cizgi sonrasinda da reduklenmis formu yazilir Standart elektrot potansiyeliStandart elektrot potansiyeli bir pildeki molekuler halde bulunan hidrojenin standart basinc altinda 105 Pa cozunmus protonlara donusmesiyle olusan bir standart elektromotor kuvveti emk degeridir Hucre potansiyeli yari hucrelerin potansiyelleri arasindaki farka baglidir Geleneksel olarak her bir elektrodun potansiyeli secilen elektrot uzerinde gerceklesen reduksiyon olarak yazilir Dolayisiyla standart elektrot potansiyelleri reduksiyon potansiyelleri olarak tablolastirilmistir ve Ered0 displaystyle mbox E red 0 seklinde gosterilir Standart hucre potansiyeli her bir elektrodun standart reduksiyon potansiyeli arasindaki fark olarak hesaplanir Ehucreo Eredo katot Eredo anot displaystyle mbox E hucre o mbox E red o katot mbox E red o anot Yari hucre standart reduksiyon potansiyelini olcmek imkansiz oldugundan Ered0 0 displaystyle mbox E red 0 0 a esdeger bir elektroda karsi gelen referansa standart reduksiyon potansiyeli degeri olarak atanir Bu prosedur icin kullanilan hucrenin yari reaksiyonu hidrojen olup standart sicaklik ve basinc kosullarinda 105 Pa 298 15K 1 mol L sifir volt verir Standart hidrojen elektrodu veya SHE laboratuvar tuplerine benzer ters cevrilmis bir cam tupten olusur Bu cam tupte ince ve hafif olan platin tel yine ince bir platin blade e baglanmistir Bu duzenek H iyonlarinin fazla bulundugu hidroklorik asit cozelttisine yerlestirilmistir Gaz hidrojen tupun icine girer ilerlerken platin ile tepkime verir Boylece yukseltgenme ve indigenme prosesleri gerceklesmesine olanak saglanir Daniells pilindeki elektrotlar ile tam anlamiyla ayni sekilde calisir Standart indirgenme potansiyelini olcmek icin SHE elektrokimyasal bir pilde elektrodlardan birini olusturarak katot veya anot olarak gorev yapar Boylece pilde uretilen elektrik akimi olculmek istenen turun standart indirgenme potansiyelini gosterir Ornegin bakirda standart indirgenme potansiyeli Pt s H2 1atm H 1M Cu2 1M Cu s displaystyle mbox Pt s mbox H 2 1atm mbox H 1M mbox Cu 2 1M mbox Cu s Ehucreo Eredo katot Eredo anot displaystyle mbox E hucre o mbox E red o katot mbox E red o anot Standart basinc ve sicaklikta pilin emk si 0 34 V dur Sonuc olarak sifir degerini alir Boylece onceki esitlik duzenlendiginde asagidaki sonuc cikar 0 34Vhucre ECu2 Cuo EH H2o displaystyle mbox 0 34V hucre mbox E mbox Cu 2 mbox Cu o mbox E mbox H mbox H 2 o 0 34Vhucre ECu2 Cuo 0 displaystyle mbox 0 34V hucre mbox E mbox Cu 2 mbox Cu o 0 Elektrokimyasal hucrelerde emk olusan redoks reaksiyonunun kendiliginden bir proses olup olmadigini tahmin etmeye yarar Toplam hucre standart potansiyelinin pozitif bir deger olmasi tepkimenin kendiliginden oldugunu gosterir Negatif bir deger de ters yonde kendiliginden bir tepkime oldugunu isaret eder Dengedeki bir hucrenin reaksiyon denklemindeki degismesi Ered0 displaystyle mbox E red 0 degerini degistirmez Cunku standart elektrod potansiyeli miktara bagli olmayan bir ozelliktir Redoks sistemlerinin kendiliginden meydana gelisiElektrokimyasal pillerde kimyasal enerji donusur Matematiksel olarak bu donusum pilin elektromotor kuvveti ile elektriksel yukun carpimi olarak gosterilir Sonucunun birimi coulombdur Electrical energy volts coulombs displaystyle mbox Electrical energy mbox volts mbox coulombs Electrical energy joules displaystyle mbox Electrical energy mbox joules Elektrokimyasal pilin toplam yuku mol sayisi ile Faraday sabitinin F carpilmasi ile bulunur Total charge nF displaystyle mbox Total charge mbox n mbox F Faraday sabiti 1 mol elektronun toplam elektriksel yukudur Deneysel olarak 96485 3 coulomb olarak olculmustur Pilin elektromotor kuvveti maksimum voltaj uretildiginde olculur Kimyasal reaksiyon dan elde edilen en fazla elektrik enerjisini hesaplamak icin bu deger kullanilir Bu enerjiye denir ve asagidaki esitlikle gosterilir Wmax Welectrical displaystyle mbox W max mbox W electrical Wmax nFEcell displaystyle mbox W max mbox nFE cell Boylece serbest enerji sistemden ayrilabilen mekanik isin bir buyuklugudur Bu degeri onceki esitlikte yerine koydugumuzda DG displaystyle Delta G cikan bu esitlik kendiligindenlik ve elektrokimyasal pil arasindaki iliskiyi ortaya cikarir DG nFEcell displaystyle Delta G mbox nFE cell Gibbs serbest enerjisi ve maksimum elektriksel is arasindaki iliski standart sicaklik ve basinc altinda sayesinde sistemin kendiliginden bir proses olup olmadigi tahmin edilebilir Kendiliginden olusan elektrokimyasal bir reaksiyon elektrokimyasal pillerde elektrik akimi uretmek icin kullanilabilir Bu butun pillerde ve yakit pillerinde temel calisma prensibidir Ornegin yakit pillerinde oksijen gazinin O2 ve hidrojen gazinin H2 birlesmesi ile su isi ve elektriksel enerji aciga cikar Karsit olarak kendiliginden olmayan elektrokimyasal reaksiyonlarin yeterli voltaj uygulanarak ileri yonde gitmesi saglanabilir Suyun oksijen ve hidrojen gazlarina elektrolizi buna tipik bir ornektir Denge sabiti ve kendiligindenlik elektrokimyasal hucrelerde Gibbs serbest enerjisi terimleri ile asagidaki gibi aciklanabilir DGo RT ln K displaystyle Delta G o mbox RT ln K nFEcello RT ln K displaystyle mbox nFE cell o mbox RT ln K Iki esitligin cozulmesi ile pilin denge sabiti ve standart potansiyeli arasindaki iliski gosterilebilir Ecello RTnFln K displaystyle mbox E cell o mbox RT over mbox nF mbox ln K Onceki esitlik seklinde gosterilebilir Ecello 0 0592Vnlog K displaystyle mbox E cell o 0 0592 mbox V over mbox n mbox log K Hucre emf sinin konsantrasyona olan bagimliligiNernst Denklemi Bir pil potansiyelinin hesaplanmasi her zaman standart sicaklik ve basinc altinda mumkun olmaz Fakat 1900 lu yillarda Alman kimyager Walther Hermann Nernst standart kosullarin saglanmadigi durumlarda da kullanilabilecek bir matematiksel formul onerdi 1800 lu yillarin ortalarinda her kosulda ise yarayan kendiliginde olan prosesler icin bir denklem onerdi DG DGo RT ln Q displaystyle Delta G Delta G o mbox RT ln Q Burada DG ndeki degisim T mutlak sicaklik R ln dogal logaritma Q Wiillard Gibbs Q nun reaktantlarin ve olusan urunlerin bagli oldugunu belirtmistir Walther 19 yuzyilin ortalarinda Williard Gibbs in calismalarindan yola cikarak DG displaystyle Delta G nin degerinin hucrenin maksimum elektriksel is degeri ile yer degistigi yeni bir matematiksel esitlik turetti nFDE nFDE RTln Q displaystyle nF Delta E nF Delta E circ RT ln Q Burada n elektron sayisi Mol urun F Faraday sabiti coulomb Mol and DE Son olarak nFDE displaystyle nF Delta E i elektrokimyasal pil potaniyel degeri ile degistirdi Yeni cikan esitlik onun adini aldi DE DEo RTnFln Q displaystyle Delta E Delta E o mbox RT over mbox nF mbox ln Q Standat kosullar kabul edildiginde Temparature 298K 25C displaystyle Temparature 298K 25C ve 8 3145JKmol displaystyle 8 3145 J over Kmol ustteki esitlik asagidaki gibi gosterilebilir DE DEo 0 0592 Vnlog Q displaystyle Delta E Delta E o mbox 0 0592 V over mbox n mbox log Q Konsantrasyon hucreleri Konsantrasyon hucreleri elektrokimyasal hucrelerdir Elektrodlari ayni maddelerden yapilmis olsa da her iki hucrede de iyonik derisimler farklidir Ornegin iki bakir elektrodun 0 05 M ve 2 M lik iki ayri mavi vitriol cozeltisine daldirildgi ve bunlarin tel ve tuz koprusu ile baglandigi bir sistem konsantrasyon tipi bir hucredir Cu2 aq 2e Cu s displaystyle Cu 2 aq 2e rightarrow mbox Cu s ne gore Cu2 displaystyle Cu 2 iyonlarinin derisimin artmasiyla sistemin indirgenme yonune kaydigi gorulmektedir Indirgenme hucrede konsantrasyonun yuksek oldugu yerde ve yukseltgenme de derisik kisimda olur Asagidaki hucre diyagrami az once bahsedilen hucreyi gosterir Cu s Cu2 0 05M Cu2 2 0M Cu s displaystyle Cu s Cu 2 0 05M Cu 2 2 0M Cu s Yari reaksiyonlar da Oxidation Cu s Cu2 0 05M 2e displaystyle Oxidation Cu s rightarrow mbox Cu 2 0 05M 2e Reduction Cu2 2 0M 2e Cu s displaystyle Reduction Cu 2 2 0M 2e rightarrow mbox Cu s Overallreaction Cu2 2 0M Cu2 0 05M displaystyle Overallreaction Cu 2 2 0M rightarrow mbox Cu 2 0 05M Hucrenin emk si da asagidaki Nernst denklemi ile hesaplanir E Eo 0 0257V2ln Cu2 diluted Cu2 concentrated displaystyle E E o 0 0257V over 2 ln Cu 2 diluted over Cu 2 concentrated Elektrotlarin ve iyonlarin buradaki gibi yari hucrelerde ayni oldugu bu tur pillerde Eo displaystyle E o degeri sifir olur Bahsedilen degerler formulde yerine konuldugunda hucrenin potansiyeli hesaplanabilir E 0 0 0257V2ln0 052 0 displaystyle E 0 0 0257V over 2 ln 0 05 over 2 0 E 0 0474V displaystyle E 0 0474V Fakat genellikle bu sonuc derisimler arasindaki orana degil de iyonlarin aktivitelerinin oranina baglidir Konsantrasyon hucreleri biyolojik arastirmalar icin sik sik kullanilmaktadir Burada membran potansiyelleri sinir sinapslarina ve kalp atislarina duyarlidir PilBir pil dogru akim veya sabit voltaj uretebilen bir veya birden fazla elektrokimyasal hucre icerebilen sistemdir Elektrokimya kurallari elektrokimyasal hucrelerdeki gibi pillerde de gecerlidir Hucreler ile arasindaki farklilik pillerin tuz koprusu gibi yardimci ogelere ihtiyacinin olmamasidir Pil kapali sistemdir Enerji alisverisi gerceklestilir Kuru pil Cinko karbon pil semasi Kuru pillerde sivi elektrolit bulunmaz Bunun yerine nemli bir elektrolit pasta icerirler pilleri buna iyi bir ornektir Bu tur hucrelerde anot ince bir tabakasi ile cevrili bir bakir barindiricidir Mangan dioksit tabakasi ile beraber bakiri cevreleyen amonyum klorur ve nisasta karisimi da bulunur Bu karisim pilin sabit durmasini ve sizinti yapmamasini saglar Katot genellikle ortada yer alan karbon bir cubugun elektrolit cozeltisine daldirilmasiyla olusan kisimdir yari reaksiyonlari asagidaki gibi birlestirmistir Anot Zn s Zn2 aq 2e displaystyle Anot Zn s rightarrow Zn 2 aq 2e Katot 2NH4 aq 2MnO2 s 2e Mn2O3 s 2NH3 aq H2O l displaystyle Katot 2NH 4 aq 2MnO 2 s 2e rightarrow Mn 2 O 3 s 2NH 3 aq H 2 O l Genel tepki displaystyle mbox Genel tepki Zn s 2NH4 aq 2MnO2 s Zn2 aq Mn2O3 s 2NH3 aq H2O l displaystyle Zn s 2NH 4 aq 2MnO 2 s rightarrow Zn 2 aq Mn 2 O 3 s 2NH 3 aq H 2 O l genellikle 1 5 V civarinda bir voltaj elde edilir Civali pil Civali piller tipta ve elektronikte bircok uygulama alani bulurlar Pil celikten yapilmis silindir seklinde katot gorevi goren bir barindirici icerir Anot bolumu de civa ve cinko amalgamindan olusan etrafi alkali bir elektrolit cinko oksit pastasi ve karisimindan olusan bir madde ile sarilmistir Civa pili yari reaksiyonlari asagida gosterilmistir Anot Zn Hg 2OH aq ZnO s H2O l 2e displaystyle Anot Zn Hg 2OH aq rightarrow ZnO s H 2 O l 2e Katot HgO s H2O l 2e Hg l 2OH aq displaystyle Katot HgO s H 2 O l 2e rightarrow Hg l 2OH aq Genel tepki displaystyle mbox Genel tepki Zn Hg HgO s ZnO s Hg l displaystyle Zn Hg HgO s rightarrow ZnO s Hg l Pil calisirken elektrolit iceriginde bir degisiklik olmaz Civa pilleri 1 35 V luk bir dogru akim uretir Kursun asit pili Kursun asit pilleri sirali alti adet hucre icerir ve otomobillerde kullanilirlar Bu tur pillerde her hucrenin anodu kursundan yapilmistir Katot kismi da bir metal levha uzerine oturtulmus kursun dioksitten yapilmistir Katot ve anot elektrolit gorevi yapan sulfurik asit cozeltisine daldirilmistir Kursun asit pillerindeki yari tepkimeler asagida gosterilmistir Anot Pb s SO42 aq PbSO4 s 2e displaystyle Anot Pb s SO 4 2 aq rightarrow PbSO 4 s 2e Katot PbO2 s 4H aq SO42 aq 2e PbSO4 s 2H2O l displaystyle Katot PbO 2 s 4H aq SO 4 2 aq 2e rightarrow PbSO 4 s 2H 2 O l Genel tepki Pb s PbO2 s 4H aq 2SO42 aq 2PbSO4 s 2H2O l displaystyle mbox Genel tepki Pb s PbO 2 s 4H aq 2SO 4 2 aq rightarrow 2PbSO 4 s 2H 2 O l Standart kosullarda her hucre 2V luk dogru akim uretebilir Boylece toplam 12 V luk bir voltaj uretilmis olur Civa ve cinko karbon pillerinden farkli olarak kursun asit pilleri tekrar sarj edilebilirdirler Eger pile disaridan bir voltaj uygulanirsa toplam reaksiyonda urunlerin elektrolizi olur desarj Bunun sonucunda pilin calismasini saglayan maddeler yenilenir Kati hal Lityum pili Kati hal pilinde sulu bir elektrolit veya nemli elektrolit pastasi yerine kati elektrolit kullanilir Bu pillere ornek olarak kati hal lityum pilleri verilebilir ki burada kati haldeki bir lityum cubuk anot bir veya cubuk katot ve iyonlarin gecisine izin verip elektronlarin gecisine izin vermeyen bir polimer de elektrolit vazifesi gorur Bu pillerin avantaji lityumun en yuksek negatif standart reduksiyon potansiyeline sahip olmasidir Lityumun ayni zamanda bir hafif metal olmasi sayesinde de daha az kutleyle 1 mol elektron uretmek mumkun olur Bu piller yeniden doldurulabilen turden olmayip 3 Volt gerilim altinda dogru akim uretirler Akisli pil Hemen hemen tum pillerde elektrotlar ve elektrolit tek bir kap icerisindedir Akisli pilde ise alisilagelmisin tersine elektrolitin buyuk kismi cozunmus reaktifler de dahil olmak uzere farkli kaplarda saklanirlar Elektrolitler elektrotlari bulunduran bir reaktor vasitasiyla pompalanir Bu tur piller genellikle buyuk olcekli enerji depolamada kullanilirlar kWh hatta birkac MWh gibi Gelistirilmis pek cok cesidi arasinda ticari oneme sahip olanlar vanadyum redoks pili ve cinko bromur pilidir Yakit hucreleri guc santrallerinde elektrik ihtiyacini karsilamak icin kullanilir Fakat elektrige donusturme islemleri yeterince etkili bir proses degildir En etkili elektrik santralleri bile 40 oraninda kimyasal enerjiyi elektrik enerjisine donusturmektedir Elektrik uretimini artirmak icin bilim adamlari elektrokimyasal metodlarla yanma reaksiyonlarinin olustugu yakit hucreleri gelistirmislerdir Boylece ihtiyac duyulan reaktantlarin tuketildikten sonra tekrar elde edilmesi saglanmaktadir Bunlardan en onemli olani oksijen hidrojen yakit pilleridir Bu pillerde iki ve nikel veya nikel oksit den olusan delikli bir elektrod bir ornegin kostik potas yerlestirilmistir Anod ve katod bolmelerinden de hidrojen ve oksijen gazi baloncuklar cikartarak elektrolite karisir Oksijen hidrojen yakit pili reaksiyonlari asagida gosterilmistir Anot 2H2 g 4OH aq 4H2O l 4e displaystyle Anot 2H 2 g 4OH aq rightarrow 4H 2 O l 4e Katod O2 g 2H2O l 4e 4OH aq displaystyle Katod O 2 g 2H 2 O l 4e rightarrow 4OH aq Toplam Reaksiyon 2H2 g O2 g 2H2O l displaystyle mbox Toplam Reaksiyon 2H 2 g O 2 g rightarrow 2H 2 O l Toplam reaksiyon hidrojen yanmasina benzerdir Yukseltgenme ve indirgenme anot ve katotda ayri ayri yer alir Bu hucrede standart indirgenme potansiyeli olcen elektroda benzer Elektrod hm molekullerin bozunmasi icin yuzey olusturur hem de elektriksel yalitkan olarak gorev yapar Bu islemler elektron aktarimindan once oldugundan dolayi adini da alir Platin nikel rodyum iyi elektrokatlistlerdir Kaynakca a b c d e f Atkins P W 2015 Chemistry a very short introduction Oxford Oxford University Press ISBN 978 0199683970 Dis baglantilarElectrochemistry net 5 Nisan 2013 tarihinde Wayback Machine sitesinde The Electrochemical Society 14 Ekim 2019 tarihinde Wayback Machine sitesinde International Society of Electrochemistry ISE 27 Agustos 2019 tarihinde Wayback Machine sitesinde Electrochemistry Dictionary at Case Western Reserve University size 388KB Experiments in Electrochemistry at Fun Science 12 Subat 2009 tarihinde Wayback Machine sitesinde
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans