Bu madde, uygun değildir. (Mayıs 2020) |
İzotoplar, periyodik tabloda aynı atom numarasına ve konuma sahip olan ve farklı nötron sayıları nedeniyle nükleon sayıları bakımından farklılık gösteren iki veya daha fazla atom türüdür. Belirli bir elementin tüm izotopları neredeyse aynı kimyasal özelliklere sahipken, farklı atomik kütlelere ve fiziksel özelliklere sahiptirler. İzotop terimi, "aynı yer" anlamına gelen Yunan kökenli isos (ἴσος "eşit") ve topos (τόπος "yer") 'den oluşur; isimin anlamı ise, tek bir elementin farklı izotoplarının periyodik tabloda aynı pozisyonda yer alması anlamına gelir.Margaret Todd tarafından 1913 yılında Frederick Soddy'ye öneri olarak sunulmuştur.
| Nükleer fizik | ||||||||||||||
 | ||||||||||||||
| Radyoaktivite Fisyon Füzyon
| ||||||||||||||

Atom çekirdeğindeki proton sayısına atom numarası denir ve nötr (iyonize olmayan) atomdaki elektron sayısına eşittir. Her atom numarası belirli bir elementi tanımlarken, izotopu tanımlamaz; belirli bir elementin atomu, nötron sayısında geniş bir aralığa sahip olabilir. Çekirdekteki nükleonların (hem protonları hem de nötronları) atomun kütle sayısıdır ve belirli bir elementin her izotopu farklı bir kütle numarasına sahiptir.
Örneğin, karbon-12, karbon-13 ve karbon-14, sırasıyla kütle numaraları 12, 13 ve 14 olan karbon elementinin üç izotopudur. Karbonun atom numarası 6'dır, yani her karbon atomunun 6 protonu vardır, böylece bu izotopların nötron sayıları sırasıyla 6, 7 ve 8'dir.
İzotop ve Nüklid
Nüklit çekirdekte belirli sayıda proton ve nötron bulunduran bir atom türüdür, örneğin 6 protonlu ve 7 nötronlu karbon-13. Nüklid kavramı (tek tek nükleer türlere atıfta bulunarak) kimyasal özellikler üzerindeki nükleer özellikleri vurgular, izotop kavramı ise (her yılda bir defa elementin tüm atomlarını gruplandırarak) nükleer üzerindeki kimyasalları vurgular. Nötron sayısının nükleer özellikler üzerinde büyük etkisi vardır, ancak kimyasal özellikler üzerindeki etkisi çoğu element için önemsizdir. Nötron sayısının atom numarasına oranının izotoplar arasında en çok değişen en hafif elementlerdir ve (hidrojen için, en hafif element olmasına rağmen, izotop etkisi biyolojiyi güçlü bir şekilde etkileyecek kadar büyüktür). İzotoplar terimi (başlangıçta da izotopik elementlerdir. Yani bazen izotopik nüklitler) karşılaştırmayı (eşanlamlılar veya izomerler gibi) ima etmek için tasarlanmıştır, örneğin: nüklitler 



Gösterim
Bir izotop veya nüklit, belirli elemanın adıyla belirtilir (bu atom numarasını gösterir), ardından bir tire ve kütle numarası (örneğin helyum-3,helyum-4, karbon-12, karbon-14, uranyum-235 ve uranyum-239). kimyasal sembolü kullanılır, örneğin "C" karbon, standart gösterim (şimdi olarak bilinen "AZE gösterim" çünkü Bir kütle numarası, Z atom numarası ve element öğesi) olduğunu gösterir, kütle sayısı (nükleon sayısı) ile kimyasal sembolün sol alt tarafına ve sol üst tarafına yazılır (örneğin 





Radyoaktif, ilkel ve kararlı izotoplar
Bazı izotoplar veya nüklitler radyoaktif ve bu nedenle radyoizotoplar veya radyonüklitler olarak adlandırılır, oysa diğerleri radyoaktif olarak çürümeye hiç rastlanmamıştır ve kararlı izotoplar veya kararlı nüklitler olarak adlandırılır. Örneğin, 14C radyoaktif bir karbon şeklidir, 12C ve 13C kararlı izotoplardır. Yeryüzünde yaklaşık 339 doğal olarak meydana gelen nüklitler vardır, bunların 286 tanesi ilkel nüklitlerdir, yani güneş sisteminin oluşumundan beri var oldukları anlamına gelir.
İlkel nüklitler, çok uzun yarı ömürleri (100 milyon yıldan fazla) olan 34 nüklitleri ve resmi olarak "kararlı nüklitler" olarak kabul edilen 252'leri içerir, çünkü çürümeye rastlanmamıştır. Çoğu durumda, bilinen nedenlerden dolayı, bir elementin kararlı izotopları varsa, bu izotoplar Dünya'da ve güneş sisteminde bulunan element bolluğunda baskındır. Bununla birlikte, üç element (tellür, indiyum ve renyum) durumunda, doğada bulunan en bol izotoplar, aslında bir veya daha fazla kararlı izotopa sahip olan bu elementlere rağmen, elemanın bir (veya iki) son derece uzun ömürlü radyoizotopudur.
Teori, görünüşe göre birçok "kararlı" izotop / nüklitin radyoaktif olduğunu ve son derece uzun yarı ömürlü olduğunu (tüm nüklitleri sonuçta kararsız hale getirecek proton bozulma olasılığını azaltığını) öngörür. Bazı kararlı nüklitler teorik olarak alfa bozulması veya çift beta bozulması gibi bilinen diğer bozulma biçimlerine enerjik olarak duyarlıdır, ancak henüz hiç bozulma ürünü gözlenmemiştir ve bu nedenle bu izotopların "gözlemsel olarak kararlı" olduğu söylenmektedir. Bu nüklitler için öngörülen yarılanma ömürleri genellikle evrenin tahmini yaşını büyük ölçüde aşmaktadır ve aslında yarılanma ömrü evrenin yaşından daha uzun olan 31 bilinen radyonüklid (örneğin Primordial nüklit) bulunmaktadır.
Yapay olarak oluşturulan radyonüklitlere ek olarak, şu anda bilinen 3.339 nüklit vardır Bunlar, kararlı olan veya 60 dakikadan daha uzun yarı ömre sahip 905 nüklidi içerir. Ayrıntılar için bakınız.
Geçmiş
Radyoaktif izotoplar
İzotopların varlığı ilk olarak 1913'te uranyum ve kurşun arasında radyo elementleri (yani radyoaktif elementler) olarak adlandırılan yaklaşık 40 farklı türün belirtildiği radyoaktif çözülme zincirleri üzerinde yapılan çalışmalara dayanır. Radyocu ve kimyacı olan Frederick Soddy tarafından önerildi, ancak periyodik tabloda sadece 11 kurşun ve uranyum elementleri dahildir.
Bu yeni radyo elemanlarını kimyasal olarak ayırma girişimleri başarısız olmuştu. Mesela Soddy bu durumu 1910'da göstermişti fakat mesothoriumun (daha sonra olduğu gösterilmiştir 228Ra) radyum (226Ra, uzun ömürlü bir izotop) ve toryum X (224Ra) ayırmak imkânsızdır. Radyo elementleri periyodik tabloya yerleştirme girişimleri, Soddy ve Kazimierz Fajans'ın bağımsız olarak radyoaktif yer değiştirme yasalarını 1913'te, alfa bozunumu periyodik tabloda solda iki yer oluşturduğu sonucuna götürmesine neden oldu. emisyon bir parça sağda bir yer üretti. Soddy, bir alfa parçacığının ve ardından iki beta parçacığının yayılmasının, başlangıç elemanı ile kimyasal olarak özdeş ancak dört birim daha hafif ve farklı radyoaktif özelliklere sahip bir elementin oluşumuna yol açtığını fark etti.
Soddy, çeşitli atom türlerinin (radyoaktif özelliklerde farklılık göstererek) tabloda aynı yeri işgal edebileceğini öne sürdü. Örneğin, uranyum-235'in alfa bozunumu toryum-231'i, aktinyum-230'un beta bozunumu toryum-230'u oluşturur. “aynı yerde” için Yunanca “izotop” terimi, fikirlerini kendisine anlattığı bir konuşma sırasında İskoç bir hekim ve aile dostu Margaret Todd tarafından Soddy'ye önerildi. 1921 Nobel Kimya Ödülü'nü kısmen izotoplarla yaptığı çalışmalar nedeniyle kazandı.
1914 yılında T. W. Richards, farklı radyoaktif kökenlere bağlı olarak izotopik kompozisyondaki değişikliklere atfedilebilen, farklı mineral kaynaklarından gelen kurşunun atom ağırlığı arasında farklılıklar buldu.
Kararlı izotoplar

Kararlı (radyoaktif olmayan) bir elementin çoklu izotoplarına yönelik ilk kanıtlar, 1912'de J. J. Thomson tarafından kanal ışınlarının (pozitif iyonlar) bileşimine yaptığı araştırmanın bir parçası olarak bulundu. Thomson, neon iyon akışlarını paralel manyetik ve elektrik alanlardan kanalize etti, sapmalarını yollarına bir fotoğraf plakası yerleştirerek ölçtü ve Thomson'ın parabol yöntemi olarak bilinen bir yöntem kullanarak kütlelerini yük oranına hesapladı. Her dere vurduğu noktada plaka üzerinde parlayan bir yama oluşturdu. Thomson, fotografik plaka üzerinde iki ayrı parabolik ışık yaması gözlemledi, bu da oranları yüklemek için farklı kütleye sahip iki çekirdek türü önerdi.
F. W Astonn daha sonra bir kütle spektrometrisi kullanan çok sayıda element için çoklu ve kararlı izotoplar keşfetti. 1919'da Aston, iki izotopik kütlenin 20 ve 22 tam sayılarına çok yakın olduğunu ve neon gazının bilinen molar kütlesine (20,2) eşit olmadığını göstermek için yeterli çözünürlüğe sahip neonu inceledi. Bu Aston'un izotopik kütleler için tam sayı kuralının bir örneğidir, bu da elementel molar kütlelerin tam sayılardan büyük sapmalarının temel olarak elemanın izotopların bir karışımı olması gerçeğinden kaynaklanmaktadır. Aston da benzer şekilde klorun molar kütlesinin (35,45) iki izotop için neredeyse integral kütlelerin ağırlıklı ortalaması olması 35Cl ve 37Cl.
İzotoplar arasındaki özelliklerde değişiklik
Kimyasal ve moleküler özellikler
Nötr bir atom, protonlarla aynı sayıya sahiptir. Dolayısıyla, belirli bir elemanın farklı izotoplarının hepsi aynı sayıda elektrona sahiptir ve benzer bir elektronik yapıyı paylaşır. Bir atomun kimyasal davranışı büyük ölçüde elektronik yapısı ile belirlendiğinden, farklı izotoplar neredeyse aynı kimyasal davranış sergiler.
Bunun ana istisnası kinetik izotop etkisidir daha büyük kütleleri nedeniyle, daha ağır izotoplar aynı elementin daha hafif izotoplarından biraz daha yavaş reaksiyona girme eğilimindedir. Bu en protium için bugüne kadar telaffuz edilir protium (1H) döteryum (2H) ve trityum (3H), çünkü döteryumun iki kat protium kütlesi vardır ve trityum, üç kat protium kütlesine sahiptir. Bu kütle farklılıkları, atomik sistemlerin ağırlık merkezini (azaltılmış kütle) değiştirerek ilgili kimyasal bağlarının davranışlarını da etkiler. Bununla birlikte, daha ağır elementler için izotoplar arasındaki nispi kütle farkı ütleüçok daha azdır, böylece kimya üzerindeki kütle farkı etkileri genellikle ihmal edilebilir. (Ağır elementler ayrıca daha hafif elementlerden nispeten daha fazla nötrona sahiptir, bu nedenle nükleer kütlenin kolektif elektronik kütleye oranı biraz daha yüksektir.)
Benzer şekilde, sadece atomlarının izotoplarında (izotopologlar) farklılık gösteren iki molekül aynı elektronik yapıya sahiptir ve bu nedenle neredeyse ayırt edilemez fiziksel ve kimyasal özelliklere sahiptir (yine deuterium ve trityum birincil istisnalardır). Titreşim modları, bir molekülün şekli ile ve onu oluşturan atomlarının kitleler tarafından belirlenir; bu nedenle farklı izotopologlar farklı titreşim modlarına sahiptir. Titreşim modları bir molekülün karşılık gelen enerjilerin fotonlarını emmesine izin verdiğinden, izotopologlar kızılötesi aralıkta farklı optik özelliklere sahiptir.
Nükleer özellikler ve kararlılık
Ayrıca bakınız: Kararlı nüklid, Kararlı izotop oranı, Nüklid listesi ve İzotopların kararlılığına göre elementlerin listesi

Atom çekirdeği, kuvvetli bir şekilde birbirine bağlı olan protonlardan ve nötronlardan oluşur. Protonlar pozitif yüklü olduğundan, birbirlerini iterler. Elektriksel olarak nötr olan nötronlar, çekirdeği iki şekilde kararlı hale getirirler. Onların copresence protonları biraz ayrı iter ve protonlar arasındaki elektrostatik itme azaltılarak birbirlerine protonlar üzerinde, çekici nükleer kuvvet uygularlar. Bu nedenle, iki veya daha fazla protonun bir çekirdeğe bağlanması için bir veya daha fazla nötron gereklidir. Proton sayısı arttıkça, nötronların kararlı bir çekirdeği sağlamak için gerekli protonlara olan oranı da artar (sağdaki grafiğe bakınız.) Örneğin, nötron: proton oranı 


Element başına izotop sayısı
Kararlı bir izotopa sahip 80 elementten, herhangi bir element için gözlemlenen en fazla kararlı izotop sayısı ondur (kalay için). Hiçbir elementin dokuz kararlı izotopu yoktur. Ksenon sadece sekiz kararlı izotoplu tek elementtir. Dört element yedi kararlı izotoplar vardır, sekiz altı kararlı izotoplar vardır, on beş kararlı izotoplar vardır, dokuz dört kararlı izotoplar vardır, beş üç kararlı izotoplar vardır, 16 iki kararlı izotoplar vardır (sayım 
Çift ve tek nükleon sayıları
Proton ve nötron oranı nükleer kararlılığı etkileyen tek faktör değildir. Atom numarası Z'nin eşit olmasına veya tuhaflığına, nötron numarası n'ye ve sonuç olarak toplamına, kütle numarası da A'ya bağlıdır. Hem Z hem de N'nin tuhaflığı, nükleer bağlanma enerjisini düşürme eğilimindedir ve garip çekirdekleri genellikle daha az kararlı hale getirir. Komşu çekirdek arasındaki nükleer bağlanma enerjisindeki bu dikkat çekici fark, özellikle bir izobarlar olan ve kendiliğinden fisyon bozunumu (pozitron emisyon dahil) Beta bozunması tarafından nötron veya proton nonoptimal sayıda kararsız izotoplar. Elektron yakalama ya da diğer daha az yaygın çürüme modları ve küme çürümenin önemli sonuçları vardır. Kararlı nüklitlerin çoğunluğu evenprotonevenneutrondur, burada tüm sayılar Z, N ve A eşittir. Tek-A kararlı nüklitler (kabaca eşit olarak) tek-proton-hatta-nötron ve evenprotonoddneutron nüklitlerine bölünür. Kararlı tek proton-tek nötron çekirdekleri en az yaygındır. (Aşağıdaki tabloya bakınız.)
| proton nötron | ÇÇ | TT | ÇT | TÇ | TOPLAM |
|---|---|---|---|---|---|
| kararlı | 146 | 5 | 53 | 48 | 252 |
| uzun süreli | 22 | 4 | 3 | 5 | 34 |
| tümü ilkel | 168 | 9 | 56 | 53 | 286 |
Atom numarası
146 çift proton çift nötron (EE) nüklitleri, tüm kararlı nüklitlerin ~%58'ini içerir ve hepsinin eşleştirme nedeniyle sıfır dönüşü vardır. Ayrıca 24 ilkel uzun ömürlü nüklitler vardır. Sonuç olarak, 2'den 82'ye kadar olan 41 çift numaralı elementin, her biri en az bir kararlı izotopa sahiptir ve bu elementlerin çoğunun birkaç ilkel izotopu vardır. Bu çift sayılı elementlerin yarısı altı veya daha fazla kararlı izotopa sahiptir. 2 proton ve 2 nötronun çift eşleştirilmesi nedeniyle helyum-4'ün aşırı kararlılığı, beş ve sekiz içeren nüklitleri önler (


53 kararlı nüklitler çift sayıda protona ve tek sayıda nötrona sahiptir. 3 sayısı da izotoplara kıyasla bir azınlıktır. Kararlı bir nüklide sahip 41 çift-Z elementi arasında, sadece iki element (argon ve seryum) çift - tek kararlı nüklitlere sahip değildir. Bir elementin üç nüklidi (kalay) vardır. Bir çift tek nüklide sahip 24 element ve iki tek çift nüklide sahip 13 element vardır. 35 primordial radyonüklitten, bölünebilirlik dahil olmak üzere dört çift tek nüklit vardır. (aşağıdaki tabloya bakınız)
| çürüme | yarılanma süresi | |
|---|---|---|
 | beta | 7.7 x 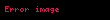 a a |
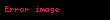 | alpha | 1.06 x 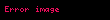 a a |
 | alpha | 7.04 x  a a |
Bölünebilirlik dahil 


Tek atom numarası
Kırk sekiz kararlı tek-proton-çift-nötron nüklitleri, eşleştirilmiş nötronlar tarafından kararlı ve tek sayılı elementlerin kararlı izotopların en önemlisidir ve tek-proton-tek-nötron nüklitlerini içermektedir. 41'in sabit izotopları olan Z = 1 ile 81 arasındaki tek sayılı elementler vardır (elementler teknekyum (43Tc) ve promethium (61Pm) kararlı izotop yok). Bu 39 tek Z elementinden 30 element (0 nötronun çift olduğu hidrojen-1 dahil) tek-çift izotop ve dokuz elemente sahiptir bunlar: klor (17Cl) potasyum (19K) bakır (29Cu) galyum (31Ga), brom (35Br), gümüş (47Ag), antimon (51Sb), iridyum (77Ir) ve talyum (81Tl). Her birinin iki tek çift kararlı izotop vardır. Bu da toplam 30 + 2(9) = 48 kararlı tek çift izotop yapar.
Beş ilkel uzun ömürlü radyoaktif tek çift izotoplar da vardır bunlar: 


Sadece beş kararlı nüklit, hem tek sayıda proton hem de tek sayıda nötron içerir. İlk dört "tek-tek" nüklitler düşük kütleli nüklitlerde meydana gelir, bunun için bir protonun bir nötrona değiştirilmesi veya tam tersi çok orantısız bir proton-nötron oranına yol açacaktır (


Nispeten kısa yarı ömürleri olan birçok Garip-garip radyonüklit (tantal-180 gibi) bilinmektedir. Genellikle, eşleştirilmiş proton ve nötronlar izobarlar için beta-çürümedir. Dokuz ilkel tek-tek nüklitten (beş kararlı ve uzun yarı ömrü olan dört radyoaktif), sadece 


Tek nötron sayısı
Tek nötron sayısına sahip aktinitler bölünebilirler (termal nötronlarla), ancak nötron sayısı çift olanlar genellikle hızlı nötronlarla parçalanabilir olsalar da, bu bölünme tam gerçekleşemez. Gözlemsel olarak kararlı tek-tek nüklitlerin sıfır olmayan tam sayı dönüşü vardır. Bunun nedeni, tek eşlenmemiş nötron ile eşlenmemiş protonun, dönüşleri hizasında (anti-hizalanmış yerine en az 1 birim toplam spin üretiyorsa) birbirlerine daha büyük bir nükleer kuvvet çekimine sahip olmalarıdır. Bu nükleer davranışın en basit durumu için döteryuma bakınız.
Sadece


| Nötron | even | odd |
|---|---|---|
| kararlı | 194 | 58 |
| uzun ömürlü | 27 | 7 |
| tümü ilkel | 221 | 65 |
Doğanın meydana gelişi
Elementler bir nüklitten (mononüklidik elementlerden) veya doğal olarak oluşan birden fazla izotoptan oluşur. Kararsız (radyoaktif) izotoplar ilkel veya post primordialdir. İlkel izotoplar, yıldız nükleosentezinin veya kozmik ışın spallation gibi başka bir nükleosentez türünün bir ürünüydü ve çürüme oranları çok yavaş olduğu için günümüze kadar devam etmiştir (örneğin uranyum-238 ve Potasyum-40). Post-primordial izotoplar, kozmik ışın bombardımanı tarafından kozmojenik nüklidler (örneğin, trityum, karbon-14) veya radyoaktif bir radyojenik nüklid gibi (örneğin radyum, uranyum) bir ilkel izotopun çürümesiyle yaratılmıştır. Birkaç izotop doğal nükleojenik nüklidler olarak sentezlenir, diğer bazı doğal nükleer ise reaksiyon tarafından doğal nükleer fisyon olarak sentezlenir. Örnek olarak nötronların başka bir atom tarafından emilmesi verilebilir.
Yukarıda açıklandığı gibi, sadece 80 elementin herhangi bir kararlı izotopu vardır ve bunların 26'sında sadece bir kararlı izotop bulunur. Bu nedenle, kararlı elementlerin yaklaşık üçte ikisi doğal olarak çoklu kararlı izotoplarda yer alır ve bir element için en fazla sayıda sabit izotop sayısıda kalay için ondur(50Sn). Burada, yeryüzünde doğal olarak bulunan yaklaşık 94 element (plütonyum dahil) bulunur, ancak bazıları plütonyum-244 gibi çok küçük miktarlarda tespit edilir. Bilim adamları, Dünya'da doğal olarak meydana gelen elementlerin (bazıları sadece radyoizotop olarak) toplamda 339 izotop (nüklid) olarak meydana geldiğini tahmin ediyorlar. Bu doğal olarak oluşan nüklidlerin sadece 252'si, şimdiki zaman itibarıyla çürümeye hiç rastlanmadıkları görülmüştür. 34 primordial nüklid (toplam 286 primordial nüklid), gibi bilinen yarı ömürleri olan radyoaktifler, güneş sisteminin başlangıcından itibaren 100 milyon yıldan daha uzun yarı ömürleri vardır. (Ayrıntılar için nüklidlerin listesine bakınız.)
Bilinen tüm kararlı nüklidler Dünya'da doğal oluşum olarak meydana gelirler. Ve diğer doğal olarak oluşan nüklidler de radyoaktif olmakla birlikte, nispeten uzun yarı ömürleri nedeniyle ya da devam eden doğal üretimin diğer araçları nedeniyle Dünya'da meydana gelirler. Bunlar yukarıda bahsedilen kozmojenik nüklitler, nükleojenik nüklidler ve uranyum radon ve radyum gibi ilkel bir radyoaktif nüklidin devam eden çürümesiyle oluşan herhangi bir radyojenik nüklidleri içerir.
Doğada bulunmayan 3000 radyoaktif nüklid, nükleer reaktörlerde ve parçacık hızlandırıcılarında oluşturulmuştur. Dünya'da doğal olarak bulunmayan birçok kısa ömürlü nüklid, yıldızlarda veya süpernovalarda doğal olarak oluşturulan spektroskopik analizlerle de gözlemlenmiştir. Örnek olarak da, Dünya'da doğal olarak bulunmayan ancak astronomik ölçekte bolca bulunan alüminyum-26'dır.
Elementlerin tablolandırılmış atomik kütleleri, farklı kütlelere sahip çoklu izotopların varlığını hesaba katan ortalamalardır. İzotopların keşfinden önce, atomik kütlenin ampirik olarak belirlenmiş olmayan değerleri bilim insanlarını şaşırtmıştır. Çünkü, bir klor örneği %75,8 klor-35 ve %24,2 klor-37 içerir ve ortalama bir atomik kütle 35,5 atomik kütle birimi verir.
Genelgeçer kozmoloji teorisine göre, yalnızca hidrojen ve helyumun izotopları eser halde bulunan lityum, berilyum, bor gibi bazı izotopların izlerini taşır. Diğer tüm nüklit yıldızlar ve süpernovada önceden meydana gelmiş enerjik partiküller arasındaki etkileşimle sentezlenirler. Ve bunların tümü Büyük Patlama sırasında oluşmuştur. (İzotop üretiminden sorumlu olduğu düşünülen çeşitli süreçlerin detayları için nükleosenteze bakınız). Dünya üzerindeki izotopların bollukları, bu süreçlerin oluşturduğu miktarlardan, galakside yayılmasından ve kararsız olan izotopların çürüme oranlarından kaynaklanır. Güneş sisteminin ilk birleşmesinden sonra, izotoplar kütleye göre yeniden dağıtıldı ve elementlerin izotopik bileşimi gezegenden gezegene biraz değişti. Bu bazen göktaşlarını izlemeyi mümkün kılabilir.
İzotopların atomik kütlesi
Atom kütlesi (
Kütle numarası boyutsuz bir miktardır. Öte yandan atomik kütle, karbon-12 atomunun kütlesine dayanan atomik kütle birimi kullanılarak ölçülür. "U" (Birleşik atomik kütle birimi için) veya "Da" (dalton için) sembolleri ile gösterilir. Bir elementin doğal olarak oluşan izotoplarının atomik kütleleri, elementin atomik kütlesini belirler. Element N izotopları içerdiğinde, aşağıdaki ifade ortalama atomik kütle için uygulanır 

m1, m2, ..., mN her bir izotopun atomik kütleleridir ve x1, ..., xN bu izotopların göreceli bolluklarıdır.
İzotopların uygulamaları
İzotopların saflaştırılması
Belirli bir elementin çeşitli izotoplarının özelliklerinden yararlanan uygulamalar vardır. İzotop ayrımı önemli bir teknolojik meydan okumadır, özellikle de uranyum veya plütonyum gibi ağır elementler ile bu ayrımı yapmak zordur. Lityum, karbon, azot ve oksijen gibi daha hafif elementler, CO (kobalt) ve NO (nobelyum) gibi bileşiklerinin gaz difüzyonu ile ayrılır. Hidrojen ve döteryumun ayrılması sıra dışıdır, çünkü Girdler sülfür işlemi fiziksel özelliklerden ziyade kimyasallara dayanır. Uranyum izotopları, gaz difüzyonu, gaz santrifüjü, lazer iyonizasyon ayrımı ve (Manhattan projesinde) bir tür üretim kütle spektrometresi ile toplu olarak ayrılmıştır.
Kimyasal ve biyolojik özelliklerin kullanımı
- İzotop analizi, belirli bir örnekteki gibi bir element izotopunun, izotopik imzasının, göreceli bolluğunun belirlenmesidir. İzotop analizi sıklıkla izotop oranı ile kütle spektrometresi ile yapılır. Özellikle biyojenik maddeler için, C (karbon), N (azot) ve O (oksijen) izotoplarının önemli varyasyonları meydana gelebilir. Bu tür varyasyonların analizi, gıda ürünlerinde tağşiş tespiti gibi geniş bir uygulama yelpazesine veya isoscapes kullanan ürünlerin coğrafi kökenlerine sahiptir. Belirli göktaşlarının Mars kaynaklı olarak tanımlanması, kısmen içinde bulunan eser gazların izotopik imzasına dayanır.
- İzotopik ikame, kinetik izotop etkisi ile bir kimyasal reaksiyon mekanizmasını belirlemek için kullanılabilir.
- Diğer bir yaygın uygulama ise izotopik etiketlemedir. Kimyasal reaksiyonlarda izleyiciler veya belirteçler olarak olağandışı izotopların kullanılmasıdır. Normal de, belirli bir elementin atomları birbirinden ayırt edilemez. Öyle ki, farklı kütlelerin izotoplarını kullanarak, farklı radyoaktif olmayan kararlı izotoplar bile kütle spektrometresi veya kızılötesi spektroskopisi ile ayırt edilebilir. Örneğin, SİLAC' da (hücre kültüründe amino asitlerle kararlı izotop etiketleme) kararlı izotopların proteinleri ölçmek için kullanılır. Radyoaktif izotoplar kullanılıyorsa, yaydıkları radyasyon ile tespit edilebilirler buna da radyoizotopik etiketleme denir.
- İzotoplar, yaygın izotop ve seyreltme yöntemi ile çeşitli elementlerin veya maddelerin konsantrasyonunu belirlemek için kullanılır. İzotopik olarak değişitirilmiş bileşiklerin bilinen miktarlarda numuneler ile karıştırılması ve elde edilen karışımların izotopik imzaları sayesinde kütle spektrometrisi belirlenir.
Nükleer özelliklerin kullanımı
- Radyoizotop etiketlemeye benzer bir teknik de, radyometrik tarihlemedir. Ayrıca kararsız bir elementin bilinen yarılanma ömrünü kullanarak, bilinen bir izotop konsantrasyonunun varlığından bu yana geçen süre hesaplanabilir. En yaygın olarak bilinen örnek ise, karbonlu malzemelerin yaşını belirlemek için kullanılan radyokarbon tarihlemesidir.
- Çeşitli spektroskopi formları, hem radyoaktif hem de kararlı olan spesifik izotopların benzersiz nükleer özelliklerine dayanır. Örneğin, nükleer manyetik rezonans (NMR) spektroskopisi sadece sıfır olmayan bir nükleer döndürmesi ile izotoplar için kullanılabilir. NMR spektroskopisi ile kullanılan en yaygın nüklidler: 1H, 2D, 15N, 13C ve 31P'dir.
- Mössbauer spektroskopisi aynı zamanda 57Fe (demir) gibi belirli izotopların nükleer geçişlerine de bağlıdır.
- Radyonüklidlerin de önemli kullanımları vardır. Nükleer enerji ve nükleer silahların geliştirilmesi için nispeten büyük miktarlarda spesifik izotop gerektirir. Nükleer tıp ve radyasyon onkolojisi, tıbbi tanı ve tedavi için sırasıyla radyoizotopları kullanmaktadır.
Ayrıca bakınız
Kaynakça
Bu madde önerilmeyen biçimde kaynaklandırılmıştır. () |
- ^ Herzog, Gregory F. (2 June 2020). "Isotope"[1] 9 Mayıs 2020 tarihinde Wayback Machine sitesinde . Encyclopedia Britannica.
- ^ Soddy, Frederick (12 Aralık 1922). "İzotopların kavramlarının kökenleri "(PDF). Nobelprize.org. s. 393. Alındı 9 Ocak 2019. Böylece kimyasal olarak özdeş elementler - ya da izotoplar, onları ilk kez bu mektupta doğaya çağırdığım gibi, periyodik tabloda aynı yeri işgal ettikleri için ...
- ^ Soddy, Frederick (1913). "İntra-atomik şarj". Doğa. 92 (2301): 399–400. Bibcode: 1913Natur..92..399S. doi: 10.1038 / 092399c0.
- ^ IUPAP Kırmızı Kitap
- ^ IUPAC Altın kitap
- ^ Anorganik Kimya II (Connelly, N. G.) IUPAC; Damhus, T.; İnorganik Kimya Hartshorn, R. M.; ve Hutton, A. T., İsimlendirme – IUPAC Tavsiyelerine 2005, Kimya Royal Society, 2005; IUPAC (McCleverty, J. A.; ve Connelly, N. G.), İsimlendirme. Muhtemelen 1958 İlk Baskı Kimya 2000 öneriler, Royal Society, 2001; (öneriler 1990) İnorganik Kimya IUPAC (Leigh, G. J.), İsimlendirme, Blackwell Science, 1990; İnorganik Kimya IUPAC, İsimlendirme, İkinci Baskı, 1970; de
- ^ "Dünyadan Kayıp Radyoaktifler"
- ^ Bu gösterim 1930'ların ikinci yarısında ortaya çıkmış gibi görünüyor. Bundan önce, neon-22 (1934) için Ne (22), neon-22 (1935) için Ne22 ve hatta kurşun-210 (1933) için Pb210 gibi çeşitli gösterimler kullanıldı.
- ^ "NuDat 2 Açıklama". 2 Ocak 2016'da Alındı.
- ^ Choppin, G.; Liljenzin, Jo; Rydberg, J. (1995). Radiochemistry and Nuclear Chemistry (İngilizce) (2. bas.). Butterworth-Heinemann. ss. 3-5.
- ^ Diğerleri de izotopların olasılığını önermişti; örneğin: (1909) Strömholm, Daniel ve Svedberg Theodor "Untersuchungen über Chemie der radyoaktif Grundstoffe II ölür." 2 (kimya soruşturma radyoaktif unsurlar), Zeitschrift für Chemie anorganischen, 63: 197-206; özellikle 206.sayfaya bakın. Alexander Thomas Cameron, Radyokimya (Londra, İngiltere: JM Dent & Sons, 1910), s. 141. (Cameron ayrıca yer değiştirme yasasını da bekliyordu .)
- ^ Ley, Willy (Ekim 1966). "Gecikmeli Keşif". Bilginize. Galaxy Bilimkurgu. sayfa 116-127.
- ^ Scerri, Eric R. (2007) Periyodik Tablo Oxford University Press, s. 176–179
- ^ Nagel, Miriam C. (1982). "Frederick Soddy: Kimyadan İzotoplara". Kimya Eğitimi Dergisi. 59 (9): 739-740. Bibcode: 1982JChEd..59..739N. DOI: / ed059p739 10.1021.
- ^ Görmek: Kasimir Fajans (1913) "Über eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente" (Radyoaktif dönüşümün türü ve ilgili radyoaktif elementlerin elektrokimyasal davranışı arasındaki ilişki üzerine), Physikalische Zeitschrift, 14: 131 -136. Soddy "yerinden edilme yasasını" açıkladı: Soddy, Frederick (1913). "Radyo Elemanları ve Periyodik Yasa". Doğa. 91 (2264): 57-58. Bibcode: 1913Natur..91 ... 57S. DOI: / 091057a0 10.1038 .. Soddy, yerinden edilme yasasını şu şekilde detaylandırdı: Soddy, Frederick (1913) "Radyoaktivite", Kimya Derneği Faaliyet Raporu, 10: 262-288. Alexander Smith Russell (1888–1972) ayrıca bir yerinden edilme yasası yayınladı: Russell, Alexander S. (1913) "Periyodik sistem ve radyo elemanları," Chemical News ve Journal of Industrial Science, 107: 49–52
- ^ Soddy ilk önce "izotop" kelimesini kullandı: Soddy, Frederick (1913). "Atom içi yük". Doğa. 92 (2301): 399-400. Bibcode: 1913Natur..92..399S. DOI: / 092399c0 10.1038.
- ^ Fleck, Alexander (1957). "Frederick Soddy". Kraliyet Cemiyeti Arkadaşlarının Biyografik Anıları. 3: 203-216. doi: 10,1098 / rsbm.1957.0014. s. 208: 1913'e kadar 'kimyasal olarak ayrılamayan radyo elementleri' ifadesini kullandık ve o sırada Soddy'nin kayınpederi Sir George'un evinde Dr. Margaret Todd ile bir salon tartışmasında izotop kelimesi önerildi. Beilby.
- ^ Budzikiewicz H, Grigsby RD (2006). "Kütle spektrometrisi ve izotopları: bir asırlık araştırma ve tartışma". Kütle Spektrometresi Yorumları. 25 (1): 146-57. Bibcode: 2006MSRv ... 25..146B. doi: 10.1002 / mas.20061. PMID 16134128.
- ^ Scerri, Eric R. (2007) Periyodik Tablo, Oxford University Press, , Ch. 6, not 44 (s. 312), Soddy'nin eski bir öğrencisi olarak tanımlanan Alexander Fleck'ten bahsediyor.
- ^ William T. Preyer, 1893 kitabında elementler arasındaki benzerlikleri göstermek için "izotop" kelimesini de kullandı. S. William T. Preyer, Das genetische System der chemischen Elemente [Kimyasal elementlerin genetik sistemi] (Berlin, Almanya: R. Friedländer ve Sohn, 1893): "Die ersteren habe ich der Kürze wegen izotop Elemente genannt, weil sie jedem der sieben içinde Stämmme der gleichen Ort, nämlich dieselbe Stuffe, einnehmen. " (Kısacası, eski "izotopik" elementleri adlandırdım, çünkü yedi ailenin her birinde [yani periyodik tablonun sütunları], yani aynı adımı [yani, periyodik sıra tablo]).
- ^ İzotop kavramlarının kökenleri Frederick Soddy, Nobel ödül dersi
- ^ Thomson, J.J. (1912). "XIX. Pozitif ışınlar üzerinde ileri deneyler". Felsefi Dergi. Seri 6. 24 (140): 209-253. DOI: / 14786440808637325 10.1080.
- ^ Thomson, J.J. (1910). "LXXXIII. Pozitif elektrik ışınları". Felsefi Dergi. Seri 6. 20 (118): 752-767. DOI: / 14786441008636962 10.1080.
- ^ Kitle spektrumları ve izotoplar Francis W. Aston, Nobel ödül dersi 1922
- ^ Sonzogni, Alejandro (2008). "Nüklidlerin Etkileşimli Grafiği". Ulusal Nükleer Veri Merkezi: Brookhaven Ulusal Laboratuvarı. Erişim tarihi: 2013-05-03.
- ^ Hult, Mikael; Wieslander, J.S .; Marissens, Gerd; Gasparro, Joël; Wätjen, Uwe; Misiaszek, Marcin (2009). "Bir yeraltı HPGe sandviç spektrometresi kullanarak 180mTa radyoaktivitesini arayın". Uygulamalı Radyasyon ve İzotoplar. 67 (5): 918-21. doi: 10.1016 / j.apradiso.2009.01.057. PMID 19246206.
- ^ "Dünyadan Kayıp Radyoaktifler". Erişim tarihi: 2012-06-16.
- ^ Jamin, Eric; Guérin, Régis; Rétif, Mélinda; Lees, Michèle; Martin, Gérard J. (2003). "Portakal Suyunda İlave Suyun Su ve Şekerlerden Elde Edilen Oksijen-18 / Oksijen-16 İzotop Oranlarının Eşzamanlı Tayini ile Geliştirilmesi". J. Agric. Food Chem. 51 (18): 5202-6. DOI: 10.1021 / jf030167m. PMID 12926859.
- ^ Treiman, A.H .; Gleason, J.D .; Bogard, D.D. (2000). "SNC meteoritleri Mars'lıdır". Gezegen. Space Sci. 48 (12–14): 1213. Bibcode: 2000P ve SS ... 48.1213T. DOI: 10.1016 / S0032-0633 (00) 00.105-7.
wikipedia, wiki, viki, vikipedia, oku, kitap, kütüphane, kütübhane, ara, ara bul, bul, herşey, ne arasanız burada,hikayeler, makale, kitaplar, öğren, wiki, bilgi, tarih, yukle, izle, telefon için, turk, türk, türkçe, turkce, nasıl yapılır, ne demek, nasıl, yapmak, yapılır, indir, ücretsiz, ücretsiz indir, bedava, bedava indir, mp3, video, mp4, 3gp, jpg, jpeg, gif, png, resim, müzik, şarkı, film, film, oyun, oyunlar, mobil, cep telefonu, telefon, android, ios, apple, samsung, iphone, xiomi, xiaomi, redmi, honor, oppo, nokia, sonya, mi, pc, web, computer, bilgisayar
Bu madde Vikipedi bicem el kitabina uygun degildir Maddeyi Vikipedi standartlarina uygun bicimde duzenleyerek Vikipedi ye katkida bulunabilirsiniz Gerekli duzenleme yapilmadan bu sablon kaldirilmamalidir Mayis 2020 Izotoplar periyodik tabloda ayni atom numarasina ve konuma sahip olan ve farkli notron sayilari nedeniyle nukleon sayilari bakimindan farklilik gosteren iki veya daha fazla atom turudur Belirli bir elementin tum izotoplari neredeyse ayni kimyasal ozelliklere sahipken farkli atomik kutlelere ve fiziksel ozelliklere sahiptirler Izotop terimi ayni yer anlamina gelen Yunan kokenli isos ἴsos esit ve topos topos yer den olusur isimin anlami ise tek bir elementin farkli izotoplarinin periyodik tabloda ayni pozisyonda yer almasi anlamina gelir Margaret Todd tarafindan 1913 yilinda Frederick Soddy ye oneri olarak sunulmustur Nukleer fizikRadyoaktivite Fisyon Fuzyon Klasik bozunmalarAlfa Beta Gama isini Parcacik bozunumuGelismis bozunmalar Emisyon reaksiyonlariNotron emisyonu Pozitron emisyonu Proton emisyonuYakalamaEksicik yakalanmasi Proton yakalama Notron yakalama FisyonKendiliginden fisyon Bilim InsanlariHenri Becquerel Marie Curie Pierre Curie Alvarez Becquerel Bethe A Bohr N Bohr Chadwick Cockcroft Ir Curie Fr Curie Pi Curie Sklodowska Curie Davisson Fermi Hahn Jensen Lawrence Mayer Meitner Oliphant Oppenheimer Purcell Rabi Rutherford Soddy Strassmann Szilard Teller Thomson Walton WignerBu kutu goruntuletartisdegistirDogal olarak olusan uc hidrojen izotopu Her izotopun bir protona sahip olmasi onlari tum hidrojen varyantlari haline getirir izotopun kimligi proton ve notron sayisi ile verilir Soldan saga izotoplar sifir notronlu protiyum IH bir notronlu doteryum 2H ve iki notronlu trityumdur 3H Atom cekirdegindeki proton sayisina atom numarasi denir ve notr iyonize olmayan atomdaki elektron sayisina esittir Her atom numarasi belirli bir elementi tanimlarken izotopu tanimlamaz belirli bir elementin atomu notron sayisinda genis bir araliga sahip olabilir Cekirdekteki nukleonlarin hem protonlari hem de notronlari atomun kutle sayisidir ve belirli bir elementin her izotopu farkli bir kutle numarasina sahiptir Ornegin karbon 12 karbon 13 ve karbon 14 sirasiyla kutle numaralari 12 13 ve 14 olan karbon elementinin uc izotopudur Karbonun atom numarasi 6 dir yani her karbon atomunun 6 protonu vardir boylece bu izotoplarin notron sayilari sirasiyla 6 7 ve 8 dir Izotop ve NuklidNuklit cekirdekte belirli sayida proton ve notron bulunduran bir atom turudur ornegin 6 protonlu ve 7 notronlu karbon 13 Nuklid kavrami tek tek nukleer turlere atifta bulunarak kimyasal ozellikler uzerindeki nukleer ozellikleri vurgular izotop kavrami ise her yilda bir defa elementin tum atomlarini gruplandirarak nukleer uzerindeki kimyasallari vurgular Notron sayisinin nukleer ozellikler uzerinde buyuk etkisi vardir ancak kimyasal ozellikler uzerindeki etkisi cogu element icin onemsizdir Notron sayisinin atom numarasina oraninin izotoplar arasinda en cok degisen en hafif elementlerdir ve hidrojen icin en hafif element olmasina ragmen izotop etkisi biyolojiyi guclu bir sekilde etkileyecek kadar buyuktur Izotoplar terimi baslangicta da izotopik elementlerdir Yani bazen izotopik nuklitler karsilastirmayi esanlamlilar veya izomerler gibi ima etmek icin tasarlanmistir ornegin nuklitler C612 displaystyle ce 12 6 C C613 displaystyle ce 13 6 C C614 displaystyle ce 14 6 C izotoplar ayni atom numarasina sahip nuklidlerdir ancak farkli kutle numaralari da vardir gibi Ar1840 displaystyle ce 40 18 Ar K1940 displaystyle ce 40 19 K Ca2040 displaystyle ce 40 20 Ca izobarlardir Bununla birlikte izotop eski bir terimdir cunku nuklitten daha iyi bilinir ve bazen nuklitin nukleer teknoloji ve r nukleer tip gibi daha uygun olabilecegi baglamlarda kullanilabilir GosterimBir izotop veya nuklit belirli elemanin adiyla belirtilir bu atom numarasini gosterir ardindan bir tire ve kutle numarasi ornegin helyum 3 helyum 4 karbon 12 karbon 14 uranyum 235 ve uranyum 239 kimyasal sembolu kullanilir ornegin C karbon standart gosterim simdi olarak bilinen AZE gosterim cunku Bir kutle numarasi Z atom numarasi ve element ogesi oldugunu gosterir kutle sayisi nukleon sayisi ile kimyasal sembolun sol alt tarafina ve sol ust tarafina yazilir ornegin He23 displaystyle ce 3 2 He He24 displaystyle ce 4 2 He C612 displaystyle ce 12 6 C C614 displaystyle ce 14 6 C ve U92239 displaystyle ce 239 92 U Atom numarasi eleman sembolu tarafindan verildiginden yalnizca ust simgedeki kutle numarasini belirtmek ve atom numarasi alt simgesini ornegin 3 disarida birakmak yaygindir 3He 4He 12C 14C 235U ve 239U M harfi bazen bir nukleer izomeri metastabil veya enerjik olarak uyarilmis bir nukleer durumu en dusuk enerjili zemin durumunun aksine belirtmek icin kutle numarasindan sonra eklenir ornegin Ta73180m displaystyle ce 180m 73 Ta tantal 180m AZE gosteriminin ortak telaffuzu asil yazildigindan farklidir He24 displaystyle ce 4 2 He yaygin olarak dort iki helyum yerine helyum dort ve 235 olarak telaffuz edilir U92235 displaystyle ce 235 92 U 235 92 uranyum yerine Amerikan Ingilizcesi ile iki otuz bes veya Ingilizce iki uc bes olarak telaffuz edilir Radyoaktif ilkel ve kararli izotoplarBazi izotoplar veya nuklitler radyoaktif ve bu nedenle radyoizotoplar veya radyonuklitler olarak adlandirilir oysa digerleri radyoaktif olarak curumeye hic rastlanmamistir ve kararli izotoplar veya kararli nuklitler olarak adlandirilir Ornegin 14C radyoaktif bir karbon seklidir 12C ve 13C kararli izotoplardir Yeryuzunde yaklasik 339 dogal olarak meydana gelen nuklitler vardir bunlarin 286 tanesi ilkel nuklitlerdir yani gunes sisteminin olusumundan beri var olduklari anlamina gelir Ilkel nuklitler cok uzun yari omurleri 100 milyon yildan fazla olan 34 nuklitleri ve resmi olarak kararli nuklitler olarak kabul edilen 252 leri icerir cunku curumeye rastlanmamistir Cogu durumda bilinen nedenlerden dolayi bir elementin kararli izotoplari varsa bu izotoplar Dunya da ve gunes sisteminde bulunan element bollugunda baskindir Bununla birlikte uc element tellur indiyum ve renyum durumunda dogada bulunan en bol izotoplar aslinda bir veya daha fazla kararli izotopa sahip olan bu elementlere ragmen elemanin bir veya iki son derece uzun omurlu radyoizotopudur Teori gorunuse gore bircok kararli izotop nuklitin radyoaktif oldugunu ve son derece uzun yari omurlu oldugunu tum nuklitleri sonucta kararsiz hale getirecek proton bozulma olasiligini azaltigini ongorur Bazi kararli nuklitler teorik olarak alfa bozulmasi veya cift beta bozulmasi gibi bilinen diger bozulma bicimlerine enerjik olarak duyarlidir ancak henuz hic bozulma urunu gozlenmemistir ve bu nedenle bu izotoplarin gozlemsel olarak kararli oldugu soylenmektedir Bu nuklitler icin ongorulen yarilanma omurleri genellikle evrenin tahmini yasini buyuk olcude asmaktadir ve aslinda yarilanma omru evrenin yasindan daha uzun olan 31 bilinen radyonuklid ornegin Primordial nuklit bulunmaktadir Yapay olarak olusturulan radyonuklitlere ek olarak su anda bilinen 3 339 nuklit vardir Bunlar kararli olan veya 60 dakikadan daha uzun yari omre sahip 905 nuklidi icerir Ayrintilar icin bakiniz GecmisRadyoaktif izotoplar Izotoplarin varligi ilk olarak 1913 te uranyum ve kursun arasinda radyo elementleri yani radyoaktif elementler olarak adlandirilan yaklasik 40 farkli turun belirtildigi radyoaktif cozulme zincirleri uzerinde yapilan calismalara dayanir Radyocu ve kimyaci olan Frederick Soddy tarafindan onerildi ancak periyodik tabloda sadece 11 kursun ve uranyum elementleri dahildir Bu yeni radyo elemanlarini kimyasal olarak ayirma girisimleri basarisiz olmustu Mesela Soddy bu durumu 1910 da gostermisti fakat mesothoriumun daha sonra oldugu gosterilmistir 228Ra radyum 226Ra uzun omurlu bir izotop ve toryum X 224Ra ayirmak imkansizdir Radyo elementleri periyodik tabloya yerlestirme girisimleri Soddy ve Kazimierz Fajans in bagimsiz olarak radyoaktif yer degistirme yasalarini 1913 te alfa bozunumu periyodik tabloda solda iki yer olusturdugu sonucuna goturmesine neden oldu emisyon bir parca sagda bir yer uretti Soddy bir alfa parcaciginin ve ardindan iki beta parcaciginin yayilmasinin baslangic elemani ile kimyasal olarak ozdes ancak dort birim daha hafif ve farkli radyoaktif ozelliklere sahip bir elementin olusumuna yol actigini fark etti Soddy cesitli atom turlerinin radyoaktif ozelliklerde farklilik gostererek tabloda ayni yeri isgal edebilecegini one surdu Ornegin uranyum 235 in alfa bozunumu toryum 231 i aktinyum 230 un beta bozunumu toryum 230 u olusturur ayni yerde icin Yunanca izotop terimi fikirlerini kendisine anlattigi bir konusma sirasinda Iskoc bir hekim ve aile dostu Margaret Todd tarafindan Soddy ye onerildi 1921 Nobel Kimya Odulu nu kismen izotoplarla yaptigi calismalar nedeniyle kazandi 1914 yilinda T W Richards farkli radyoaktif kokenlere bagli olarak izotopik kompozisyondaki degisikliklere atfedilebilen farkli mineral kaynaklarindan gelen kursunun atom agirligi arasinda farkliliklar buldu Kararli izotoplar J J Thomson in fotograf plakasinin sag alt kosesinde neonun iki izotopu icin ayri etki isaretleri vardir neon 20 ve neon 22 Kararli radyoaktif olmayan bir elementin coklu izotoplarina yonelik ilk kanitlar 1912 de J J Thomson tarafindan kanal isinlarinin pozitif iyonlar bilesimine yaptigi arastirmanin bir parcasi olarak bulundu Thomson neon iyon akislarini paralel manyetik ve elektrik alanlardan kanalize etti sapmalarini yollarina bir fotograf plakasi yerlestirerek olctu ve Thomson in parabol yontemi olarak bilinen bir yontem kullanarak kutlelerini yuk oranina hesapladi Her dere vurdugu noktada plaka uzerinde parlayan bir yama olusturdu Thomson fotografik plaka uzerinde iki ayri parabolik isik yamasi gozlemledi bu da oranlari yuklemek icin farkli kutleye sahip iki cekirdek turu onerdi F W Astonn daha sonra bir kutle spektrometrisi kullanan cok sayida element icin coklu ve kararli izotoplar kesfetti 1919 da Aston iki izotopik kutlenin 20 ve 22 tam sayilarina cok yakin oldugunu ve neon gazinin bilinen molar kutlesine 20 2 esit olmadigini gostermek icin yeterli cozunurluge sahip neonu inceledi Bu Aston un izotopik kutleler icin tam sayi kuralinin bir ornegidir bu da elementel molar kutlelerin tam sayilardan buyuk sapmalarinin temel olarak elemanin izotoplarin bir karisimi olmasi gerceginden kaynaklanmaktadir Aston da benzer sekilde klorun molar kutlesinin 35 45 iki izotop icin neredeyse integral kutlelerin agirlikli ortalamasi olmasi 35Cl ve 37Cl Izotoplar arasindaki ozelliklerde degisiklikKimyasal ve molekuler ozellikler Notr bir atom protonlarla ayni sayiya sahiptir Dolayisiyla belirli bir elemanin farkli izotoplarinin hepsi ayni sayida elektrona sahiptir ve benzer bir elektronik yapiyi paylasir Bir atomun kimyasal davranisi buyuk olcude elektronik yapisi ile belirlendiginden farkli izotoplar neredeyse ayni kimyasal davranis sergiler Bunun ana istisnasi kinetik izotop etkisidir daha buyuk kutleleri nedeniyle daha agir izotoplar ayni elementin daha hafif izotoplarindan biraz daha yavas reaksiyona girme egilimindedir Bu en protium icin bugune kadar telaffuz edilir protium 1H doteryum 2H ve trityum 3H cunku doteryumun iki kat protium kutlesi vardir ve trityum uc kat protium kutlesine sahiptir Bu kutle farkliliklari atomik sistemlerin agirlik merkezini azaltilmis kutle degistirerek ilgili kimyasal baglarinin davranislarini da etkiler Bununla birlikte daha agir elementler icin izotoplar arasindaki nispi kutle farki utleucok daha azdir boylece kimya uzerindeki kutle farki etkileri genellikle ihmal edilebilir Agir elementler ayrica daha hafif elementlerden nispeten daha fazla notrona sahiptir bu nedenle nukleer kutlenin kolektif elektronik kutleye orani biraz daha yuksektir Benzer sekilde sadece atomlarinin izotoplarinda izotopologlar farklilik gosteren iki molekul ayni elektronik yapiya sahiptir ve bu nedenle neredeyse ayirt edilemez fiziksel ve kimyasal ozelliklere sahiptir yine deuterium ve trityum birincil istisnalardir Titresim modlari bir molekulun sekli ile ve onu olusturan atomlarinin kitleler tarafindan belirlenir bu nedenle farkli izotopologlar farkli titresim modlarina sahiptir Titresim modlari bir molekulun karsilik gelen enerjilerin fotonlarini emmesine izin verdiginden izotopologlar kizilotesi aralikta farkli optik ozelliklere sahiptir Nukleer ozellikler ve kararlilik Ayrica bakiniz Kararli nuklid Kararli izotop orani Nuklid listesi ve Izotoplarin kararliligina gore elementlerin listesi Izotop yarilanma omru Kararli izotoplar icin cizim Z ogesi numarasi buyudukce Z N satirindan ayrilir Atom cekirdegi kuvvetli bir sekilde birbirine bagli olan protonlardan ve notronlardan olusur Protonlar pozitif yuklu oldugundan birbirlerini iterler Elektriksel olarak notr olan notronlar cekirdegi iki sekilde kararli hale getirirler Onlarin copresence protonlari biraz ayri iter ve protonlar arasindaki elektrostatik itme azaltilarak birbirlerine protonlar uzerinde cekici nukleer kuvvet uygularlar Bu nedenle iki veya daha fazla protonun bir cekirdege baglanmasi icin bir veya daha fazla notron gereklidir Proton sayisi arttikca notronlarin kararli bir cekirdegi saglamak icin gerekli protonlara olan orani da artar sagdaki grafige bakiniz Ornegin notron proton orani He23 displaystyle ce 3 2 He 1 2 notron proton orani U92238 displaystyle ce 238 92U 3 2 den buyuktur Bir dizi daha hafif element 1 1 Z N oranina sahip kararli nuklidlere sahiptir Nukleer Ca2040 displaystyle ce 40 20 Ca kalsiyum 40 gozlemsel olarak ayni sayida notron ve protona sahip en agir kararli nukliddir teorik olarak en agir kararli olan kukurt 32 dir Kalsiyum 40 tan daha agir olan tum kararli nukleerler protonlardan daha fazla notron icerir Element basina izotop sayisi Kararli bir izotopa sahip 80 elementten herhangi bir element icin gozlemlenen en fazla kararli izotop sayisi ondur kalay icin Hicbir elementin dokuz kararli izotopu yoktur Ksenon sadece sekiz kararli izotoplu tek elementtir Dort element yedi kararli izotoplar vardir sekiz alti kararli izotoplar vardir on bes kararli izotoplar vardir dokuz dort kararli izotoplar vardir bes uc kararli izotoplar vardir 16 iki kararli izotoplar vardir sayim Ta73180m displaystyle ce 180m 73 Ta kararli olarak ve 26 elementin sadece tek bir kararli izotopu vardir bunlardan 19 tanesi mononuklidik elementlerdir dogal elementin atom agirligini yuksek hassasiyete hakim ve sabitleyen tek bir ilkel kararli izotopa sahiptir 3 radyoaktif mononuklidik element de olusur Toplamda curumeye rastlanmayan 252 nuklid vardir Bir veya daha fazla kararli izotopa sahip 80 element icin ortalama kararli izotop sayisi element basina 252 80 3 15 izotoptur Cift ve tek nukleon sayilari Proton ve notron orani nukleer kararliligi etkileyen tek faktor degildir Atom numarasi Z nin esit olmasina veya tuhafligina notron numarasi n ye ve sonuc olarak toplamina kutle numarasi da A ya baglidir Hem Z hem de N nin tuhafligi nukleer baglanma enerjisini dusurme egilimindedir ve garip cekirdekleri genellikle daha az kararli hale getirir Komsu cekirdek arasindaki nukleer baglanma enerjisindeki bu dikkat cekici fark ozellikle bir izobarlar olan ve kendiliginden fisyon bozunumu pozitron emisyon dahil Beta bozunmasi tarafindan notron veya proton nonoptimal sayida kararsiz izotoplar Elektron yakalama ya da diger daha az yaygin curume modlari ve kume curumenin onemli sonuclari vardir Kararli nuklitlerin cogunlugu evenprotonevenneutrondur burada tum sayilar Z N ve A esittir Tek A kararli nuklitler kabaca esit olarak tek proton hatta notron ve evenprotonoddneutron nuklitlerine bolunur Kararli tek proton tek notron cekirdekleri en az yaygindir Asagidaki tabloya bakiniz Cift tek Z N Hidrojen 1 OE olarak dahil edilmistir proton notron CC TT CT TC TOPLAMkararli 146 5 53 48 252uzun sureli 22 4 3 5 34tumu ilkel 168 9 56 53 286Atom numarasi 146 cift proton cift notron EE nuklitleri tum kararli nuklitlerin 58 ini icerir ve hepsinin eslestirme nedeniyle sifir donusu vardir Ayrica 24 ilkel uzun omurlu nuklitler vardir Sonuc olarak 2 den 82 ye kadar olan 41 cift numarali elementin her biri en az bir kararli izotopa sahiptir ve bu elementlerin cogunun birkac ilkel izotopu vardir Bu cift sayili elementlerin yarisi alti veya daha fazla kararli izotopa sahiptir 2 proton ve 2 notronun cift eslestirilmesi nedeniyle helyum 4 un asiri kararliligi bes ve sekiz iceren nuklitleri onler He25 displaystyle ce 5 2 He Li35 displaystyle ce 5 3 Li Be48 displaystyle ce 8 4Be Yildizlarda nukleer fuzyon yoluyla daha agir elementlerin birikmesi icin platformlar olarak hizmet edecek kadar uzun sureli olan nukleonlar vardir bkz uclu alfa sureci 53 kararli nuklitler cift sayida protona ve tek sayida notrona sahiptir 3 sayisi da izotoplara kiyasla bir azinliktir Kararli bir nuklide sahip 41 cift Z elementi arasinda sadece iki element argon ve seryum cift tek kararli nuklitlere sahip degildir Bir elementin uc nuklidi kalay vardir Bir cift tek nuklide sahip 24 element ve iki tek cift nuklide sahip 13 element vardir 35 primordial radyonuklitten bolunebilirlik dahil olmak uzere dort cift tek nuklit vardir asagidaki tabloya bakiniz Cift tek uzun omurlu curume yarilanma suresiCd48113 displaystyle ce 113 48 Cd beta 7 7 x 1015 displaystyle 10 15 aSm62147 displaystyle ce 147 62 Sm alpha 1 06 x 1011 displaystyle 10 11 aU92235 displaystyle ce 235 92 U alpha 7 04 x 108 displaystyle 10 8 a Bolunebilirlik dahil U92235 displaystyle ce 235 92U tek notron sayilari cift tek nuklidler notron eslestirme etkilerinden kaynaklanan enerji nedeniyle buyuk notron yakalama kesitlerine sahip olma egilimindedir Bu kararli garip proton notron atom bile dogada bolluk tarafindan nadir olarak gorulur Cunku kendisi de ilkel bolluk icine girmek egilimindedir Diger kararli izotop ve notron yakalama hem S sureci ve R surecinde yildiz nukleosentezi sirasinda olmalidir Bu nedenle sadece Pt78195 displaystyle ce 195 78 Pt ve Be49 displaystyle ce 9 4Be elementlerinin en dogal bol izotoplaridir Tek atom numarasi Kirk sekiz kararli tek proton cift notron nuklitleri eslestirilmis notronlar tarafindan kararli ve tek sayili elementlerin kararli izotoplarin en onemlisidir ve tek proton tek notron nuklitlerini icermektedir 41 in sabit izotoplari olan Z 1 ile 81 arasindaki tek sayili elementler vardir elementler teknekyum 43Tc ve promethium 61Pm kararli izotop yok Bu 39 tek Z elementinden 30 element 0 notronun cift oldugu hidrojen 1 dahil tek cift izotop ve dokuz elemente sahiptir bunlar klor 17Cl potasyum 19K bakir 29Cu galyum 31Ga brom 35Br gumus 47Ag antimon 51Sb iridyum 77Ir ve talyum 81Tl Her birinin iki tek cift kararli izotop vardir Bu da toplam 30 2 9 48 kararli tek cift izotop yapar Bes ilkel uzun omurlu radyoaktif tek cift izotoplar da vardir bunlar Rb3787 displaystyle ce 87 37 Rb In49115 displaystyle ce 115 49In Re75187 displaystyle ce 187 75Re Eu63151 displaystyle ce 151 63Eu ve Bi83209 displaystyle ce 209 83Bi dir Son ikisi sadece son zamanlarda curumeye basladi ve bunlarin yari omurleri 1018 yildan daha buyuktur Sadece bes kararli nuklit hem tek sayida proton hem de tek sayida notron icerir Ilk dort tek tek nuklitler dusuk kutleli nuklitlerde meydana gelir bunun icin bir protonun bir notrona degistirilmesi veya tam tersi cok orantisiz bir proton notron oranina yol acacaktir Hi12 displaystyle ce 2 1 Hi Li36 displaystyle ce 6 3Li B510 displaystyle ce 10 5 B ve N714 displaystyle ce 14 7 N cevrimi 1 1 3 1 Digerleri kararli tek tek nuklit Ta73180m displaystyle ce 180m 73 Ta 9 a cevirmek ve 252 kararli izotopun en nadir oldugu dusunulmektedir Ve henuz deneysel girisimlere ragmen curume gozlemlenmemis olan tek ilkel nukleer izomerdir Nispeten kisa yari omurleri olan bircok Garip garip radyonuklit tantal 180 gibi bilinmektedir Genellikle eslestirilmis proton ve notronlar izobarlar icin beta curumedir Dokuz ilkel tek tek nuklitten bes kararli ve uzun yari omru olan dort radyoaktif sadece N714 displaystyle ce 14 7N ortak bir elementin en yaygin izotopudur Bunun nedeni CNO dongusunun bir parcasi oldugu icin olmasidir Nuklitler Li36 displaystyle ce 6 3 Li ve B510 displaystyle ce 10 5 B diger hafif elementlere kiyasla kendilerini nadir elementlerin azinlik izotoplari olarak gorurler Diger alti izotoplar da kendi elementlerinin az da olsa dogal bolluk yuzdesini olustururlar Tek notron sayisi Tek notron sayisina sahip aktinitler bolunebilirler termal notronlarla ancak notron sayisi cift olanlar genellikle hizli notronlarla parcalanabilir olsalar da bu bolunme tam gerceklesemez Gozlemsel olarak kararli tek tek nuklitlerin sifir olmayan tam sayi donusu vardir Bunun nedeni tek eslenmemis notron ile eslenmemis protonun donusleri hizasinda anti hizalanmis yerine en az 1 birim toplam spin uretiyorsa birbirlerine daha buyuk bir nukleer kuvvet cekimine sahip olmalaridir Bu nukleer davranisin en basit durumu icin doteryuma bakiniz SadecePt78195 displaystyle ce 195 78 Pt Be49 displaystyle ce 9 4Be ve N714 displaystyle ce 14 7 N nin tek notron numarasi ve elementin en dogal bol izotopu vardir Asagidaki tabloya bakiniz Notron sayisi paritesi H1 displaystyle ce H 1 0 notron dahil Notron even oddkararli 194 58uzun omurlu 27 7tumu ilkel 221 65Doganin meydana gelisiElementler bir nuklitten mononuklidik elementlerden veya dogal olarak olusan birden fazla izotoptan olusur Kararsiz radyoaktif izotoplar ilkel veya post primordialdir Ilkel izotoplar yildiz nukleosentezinin veya kozmik isin spallation gibi baska bir nukleosentez turunun bir urunuydu ve curume oranlari cok yavas oldugu icin gunumuze kadar devam etmistir ornegin uranyum 238 ve Potasyum 40 Post primordial izotoplar kozmik isin bombardimani tarafindan kozmojenik nuklidler ornegin trityum karbon 14 veya radyoaktif bir radyojenik nuklid gibi ornegin radyum uranyum bir ilkel izotopun curumesiyle yaratilmistir Birkac izotop dogal nukleojenik nuklidler olarak sentezlenir diger bazi dogal nukleer ise reaksiyon tarafindan dogal nukleer fisyon olarak sentezlenir Ornek olarak notronlarin baska bir atom tarafindan emilmesi verilebilir Yukarida aciklandigi gibi sadece 80 elementin herhangi bir kararli izotopu vardir ve bunlarin 26 sinda sadece bir kararli izotop bulunur Bu nedenle kararli elementlerin yaklasik ucte ikisi dogal olarak coklu kararli izotoplarda yer alir ve bir element icin en fazla sayida sabit izotop sayisida kalay icin ondur 50Sn Burada yeryuzunde dogal olarak bulunan yaklasik 94 element plutonyum dahil bulunur ancak bazilari plutonyum 244 gibi cok kucuk miktarlarda tespit edilir Bilim adamlari Dunya da dogal olarak meydana gelen elementlerin bazilari sadece radyoizotop olarak toplamda 339 izotop nuklid olarak meydana geldigini tahmin ediyorlar Bu dogal olarak olusan nuklidlerin sadece 252 si simdiki zaman itibariyla curumeye hic rastlanmadiklari gorulmustur 34 primordial nuklid toplam 286 primordial nuklid gibi bilinen yari omurleri olan radyoaktifler gunes sisteminin baslangicindan itibaren 100 milyon yildan daha uzun yari omurleri vardir Ayrintilar icin nuklidlerin listesine bakiniz Bilinen tum kararli nuklidler Dunya da dogal olusum olarak meydana gelirler Ve diger dogal olarak olusan nuklidler de radyoaktif olmakla birlikte nispeten uzun yari omurleri nedeniyle ya da devam eden dogal uretimin diger araclari nedeniyle Dunya da meydana gelirler Bunlar yukarida bahsedilen kozmojenik nuklitler nukleojenik nuklidler ve uranyum radon ve radyum gibi ilkel bir radyoaktif nuklidin devam eden curumesiyle olusan herhangi bir radyojenik nuklidleri icerir Dogada bulunmayan 3000 radyoaktif nuklid nukleer reaktorlerde ve parcacik hizlandiricilarinda olusturulmustur Dunya da dogal olarak bulunmayan bircok kisa omurlu nuklid yildizlarda veya supernovalarda dogal olarak olusturulan spektroskopik analizlerle de gozlemlenmistir Ornek olarak da Dunya da dogal olarak bulunmayan ancak astronomik olcekte bolca bulunan aluminyum 26 dir Elementlerin tablolandirilmis atomik kutleleri farkli kutlelere sahip coklu izotoplarin varligini hesaba katan ortalamalardir Izotoplarin kesfinden once atomik kutlenin ampirik olarak belirlenmis olmayan degerleri bilim insanlarini sasirtmistir Cunku bir klor ornegi 75 8 klor 35 ve 24 2 klor 37 icerir ve ortalama bir atomik kutle 35 5 atomik kutle birimi verir Genelgecer kozmoloji teorisine gore yalnizca hidrojen ve helyumun izotoplari eser halde bulunan lityum berilyum bor gibi bazi izotoplarin izlerini tasir Diger tum nuklit yildizlar ve supernovada onceden meydana gelmis enerjik partikuller arasindaki etkilesimle sentezlenirler Ve bunlarin tumu Buyuk Patlama sirasinda olusmustur Izotop uretiminden sorumlu oldugu dusunulen cesitli sureclerin detaylari icin nukleosenteze bakiniz Dunya uzerindeki izotoplarin bolluklari bu sureclerin olusturdugu miktarlardan galakside yayilmasindan ve kararsiz olan izotoplarin curume oranlarindan kaynaklanir Gunes sisteminin ilk birlesmesinden sonra izotoplar kutleye gore yeniden dagitildi ve elementlerin izotopik bilesimi gezegenden gezegene biraz degisti Bu bazen goktaslarini izlemeyi mumkun kilabilir Izotoplarin atomik kutlesiAtom kutlesi mr displaystyle ce m r bir izotopun nuklid esas olarak kutle numarasi yani cekirdegindeki nukleonlarin sayisi ile belirlenir Kucuk duzeltmeler cekirdegin baglanma enerjisinden bkz kitle hatasi proton ve notron arasindaki kutle farkindan ve atomla iliskili elektronlarin kutlesinden kaynaklanir cunku elektron ve nukleon orani izotoplar arasindaki farkliligi gosterir Kutle numarasi boyutsuz bir miktardir Ote yandan atomik kutle karbon 12 atomunun kutlesine dayanan atomik kutle birimi kullanilarak olculur U Birlesik atomik kutle birimi icin veya Da dalton icin sembolleri ile gosterilir Bir elementin dogal olarak olusan izotoplarinin atomik kutleleri elementin atomik kutlesini belirler Element N izotoplari icerdiginde asagidaki ifade ortalama atomik kutle icin uygulanir ma displaystyle bar ma m a m1x1 m2x2 mNxN displaystyle overline m a m 1 x 1 m 2 x 2 m N x N m1 m2 mN her bir izotopun atomik kutleleridir ve x1 xN bu izotoplarin goreceli bolluklaridir Izotoplarin uygulamalariIzotoplarin saflastirilmasi Belirli bir elementin cesitli izotoplarinin ozelliklerinden yararlanan uygulamalar vardir Izotop ayrimi onemli bir teknolojik meydan okumadir ozellikle de uranyum veya plutonyum gibi agir elementler ile bu ayrimi yapmak zordur Lityum karbon azot ve oksijen gibi daha hafif elementler CO kobalt ve NO nobelyum gibi bilesiklerinin gaz difuzyonu ile ayrilir Hidrojen ve doteryumun ayrilmasi sira disidir cunku Girdler sulfur islemi fiziksel ozelliklerden ziyade kimyasallara dayanir Uranyum izotoplari gaz difuzyonu gaz santrifuju lazer iyonizasyon ayrimi ve Manhattan projesinde bir tur uretim kutle spektrometresi ile toplu olarak ayrilmistir Kimyasal ve biyolojik ozelliklerin kullanimi Izotop analizi belirli bir ornekteki gibi bir element izotopunun izotopik imzasinin goreceli bollugunun belirlenmesidir Izotop analizi siklikla izotop orani ile kutle spektrometresi ile yapilir Ozellikle biyojenik maddeler icin C karbon N azot ve O oksijen izotoplarinin onemli varyasyonlari meydana gelebilir Bu tur varyasyonlarin analizi gida urunlerinde tagsis tespiti gibi genis bir uygulama yelpazesine veya isoscapes kullanan urunlerin cografi kokenlerine sahiptir Belirli goktaslarinin Mars kaynakli olarak tanimlanmasi kismen icinde bulunan eser gazlarin izotopik imzasina dayanir Izotopik ikame kinetik izotop etkisi ile bir kimyasal reaksiyon mekanizmasini belirlemek icin kullanilabilir Diger bir yaygin uygulama ise izotopik etiketlemedir Kimyasal reaksiyonlarda izleyiciler veya belirtecler olarak olagandisi izotoplarin kullanilmasidir Normal de belirli bir elementin atomlari birbirinden ayirt edilemez Oyle ki farkli kutlelerin izotoplarini kullanarak farkli radyoaktif olmayan kararli izotoplar bile kutle spektrometresi veya kizilotesi spektroskopisi ile ayirt edilebilir Ornegin SILAC da hucre kulturunde amino asitlerle kararli izotop etiketleme kararli izotoplarin proteinleri olcmek icin kullanilir Radyoaktif izotoplar kullaniliyorsa yaydiklari radyasyon ile tespit edilebilirler buna da radyoizotopik etiketleme denir Izotoplar yaygin izotop ve seyreltme yontemi ile cesitli elementlerin veya maddelerin konsantrasyonunu belirlemek icin kullanilir Izotopik olarak degisitirilmis bilesiklerin bilinen miktarlarda numuneler ile karistirilmasi ve elde edilen karisimlarin izotopik imzalari sayesinde kutle spektrometrisi belirlenir Nukleer ozelliklerin kullanimi Radyoizotop etiketlemeye benzer bir teknik de radyometrik tarihlemedir Ayrica kararsiz bir elementin bilinen yarilanma omrunu kullanarak bilinen bir izotop konsantrasyonunun varligindan bu yana gecen sure hesaplanabilir En yaygin olarak bilinen ornek ise karbonlu malzemelerin yasini belirlemek icin kullanilan radyokarbon tarihlemesidir Cesitli spektroskopi formlari hem radyoaktif hem de kararli olan spesifik izotoplarin benzersiz nukleer ozelliklerine dayanir Ornegin nukleer manyetik rezonans NMR spektroskopisi sadece sifir olmayan bir nukleer dondurmesi ile izotoplar icin kullanilabilir NMR spektroskopisi ile kullanilan en yaygin nuklidler 1H 2D 15N 13C ve 31P dir Mossbauer spektroskopisi ayni zamanda 57Fe demir gibi belirli izotoplarin nukleer gecislerine de baglidir Radyonuklidlerin de onemli kullanimlari vardir Nukleer enerji ve nukleer silahlarin gelistirilmesi icin nispeten buyuk miktarlarda spesifik izotop gerektirir Nukleer tip ve radyasyon onkolojisi tibbi tani ve tedavi icin sirasiyla radyoizotoplari kullanmaktadir Ayrica bakinizAtom IzotonlarKaynakcaBu madde onerilmeyen bicimde kaynaklandirilmistir Gosterilen kaynaklar kaynak gosterme sablonlari kullanilarak dipnot belirtme bicemine uygun olarak duzenlenmelidir Bu sablonun nasil ve ne zaman kaldirilmasi gerektigini ogrenin Herzog Gregory F 2 June 2020 Isotope 1 9 Mayis 2020 tarihinde Wayback Machine sitesinde Encyclopedia Britannica Soddy Frederick 12 Aralik 1922 Izotoplarin kavramlarinin kokenleri PDF Nobelprize org s 393 Alindi 9 Ocak 2019 Boylece kimyasal olarak ozdes elementler ya da izotoplar onlari ilk kez bu mektupta dogaya cagirdigim gibi periyodik tabloda ayni yeri isgal ettikleri icin Soddy Frederick 1913 Intra atomik sarj Doga 92 2301 399 400 Bibcode 1913Natur 92 399S doi 10 1038 092399c0 IUPAP Kirmizi Kitap IUPAC Altin kitap Anorganik Kimya II Connelly N G IUPAC Damhus T Inorganik Kimya Hartshorn R M ve Hutton A T Isimlendirme IUPAC Tavsiyelerine 2005 Kimya Royal Society 2005 IUPAC McCleverty J A ve Connelly N G Isimlendirme Muhtemelen 1958 Ilk Baski Kimya 2000 oneriler Royal Society 2001 oneriler 1990 Inorganik Kimya IUPAC Leigh G J Isimlendirme Blackwell Science 1990 Inorganik Kimya IUPAC Isimlendirme Ikinci Baski 1970 de Dunyadan Kayip Radyoaktifler Bu gosterim 1930 larin ikinci yarisinda ortaya cikmis gibi gorunuyor Bundan once neon 22 1934 icin Ne 22 neon 22 1935 icin Ne22 ve hatta kursun 210 1933 icin Pb210 gibi cesitli gosterimler kullanildi NuDat 2 Aciklama 2 Ocak 2016 da Alindi Choppin G Liljenzin Jo Rydberg J 1995 Radiochemistry and Nuclear Chemistry Ingilizce 2 bas Butterworth Heinemann ss 3 5 Digerleri de izotoplarin olasiligini onermisti ornegin 1909 Stromholm Daniel ve Svedberg Theodor Untersuchungen uber Chemie der radyoaktif Grundstoffe II olur 2 kimya sorusturma radyoaktif unsurlar Zeitschrift fur Chemie anorganischen 63 197 206 ozellikle 206 sayfaya bakin Alexander Thomas Cameron Radyokimya Londra Ingiltere JM Dent amp Sons 1910 s 141 Cameron ayrica yer degistirme yasasini da bekliyordu Ley Willy Ekim 1966 Gecikmeli Kesif Bilginize Galaxy Bilimkurgu sayfa 116 127 Scerri Eric R 2007 Periyodik Tablo Oxford University Press s 176 179 ISBN 0 19 530573 6 Nagel Miriam C 1982 Frederick Soddy Kimyadan Izotoplara Kimya Egitimi Dergisi 59 9 739 740 Bibcode 1982JChEd 59 739N DOI ed059p739 10 1021 Gormek Kasimir Fajans 1913 Uber eine Beziehung zwischen der Art einer radioaktiven Umwandlung und dem elektrochemischen Verhalten der betreffenden Radioelemente Radyoaktif donusumun turu ve ilgili radyoaktif elementlerin elektrokimyasal davranisi arasindaki iliski uzerine Physikalische Zeitschrift 14 131 136 Soddy yerinden edilme yasasini acikladi Soddy Frederick 1913 Radyo Elemanlari ve Periyodik Yasa Doga 91 2264 57 58 Bibcode 1913Natur 91 57S DOI 091057a0 10 1038 Soddy yerinden edilme yasasini su sekilde detaylandirdi Soddy Frederick 1913 Radyoaktivite Kimya Dernegi Faaliyet Raporu 10 262 288 Alexander Smith Russell 1888 1972 ayrica bir yerinden edilme yasasi yayinladi Russell Alexander S 1913 Periyodik sistem ve radyo elemanlari Chemical News ve Journal of Industrial Science 107 49 52 Soddy ilk once izotop kelimesini kullandi Soddy Frederick 1913 Atom ici yuk Doga 92 2301 399 400 Bibcode 1913Natur 92 399S DOI 092399c0 10 1038 Fleck Alexander 1957 Frederick Soddy Kraliyet Cemiyeti Arkadaslarinin Biyografik Anilari 3 203 216 doi 10 1098 rsbm 1957 0014 s 208 1913 e kadar kimyasal olarak ayrilamayan radyo elementleri ifadesini kullandik ve o sirada Soddy nin kayinpederi Sir George un evinde Dr Margaret Todd ile bir salon tartismasinda izotop kelimesi onerildi Beilby Budzikiewicz H Grigsby RD 2006 Kutle spektrometrisi ve izotoplari bir asirlik arastirma ve tartisma Kutle Spektrometresi Yorumlari 25 1 146 57 Bibcode 2006MSRv 25 146B doi 10 1002 mas 20061 PMID 16134128 Scerri Eric R 2007 Periyodik Tablo Oxford University Press ISBN 0 19 530573 6 Ch 6 not 44 s 312 Soddy nin eski bir ogrencisi olarak tanimlanan Alexander Fleck ten bahsediyor William T Preyer 1893 kitabinda elementler arasindaki benzerlikleri gostermek icin izotop kelimesini de kullandi S William T Preyer Das genetische System der chemischen Elemente Kimyasal elementlerin genetik sistemi Berlin Almanya R Friedlander ve Sohn 1893 Die ersteren habe ich der Kurze wegen izotop Elemente genannt weil sie jedem der sieben icinde Stammme der gleichen Ort namlich dieselbe Stuffe einnehmen Kisacasi eski izotopik elementleri adlandirdim cunku yedi ailenin her birinde yani periyodik tablonun sutunlari yani ayni adimi yani periyodik sira tablo Izotop kavramlarinin kokenleri Frederick Soddy Nobel odul dersi Thomson J J 1912 XIX Pozitif isinlar uzerinde ileri deneyler Felsefi Dergi Seri 6 24 140 209 253 DOI 14786440808637325 10 1080 Thomson J J 1910 LXXXIII Pozitif elektrik isinlari Felsefi Dergi Seri 6 20 118 752 767 DOI 14786441008636962 10 1080 Kitle spektrumlari ve izotoplar Francis W Aston Nobel odul dersi 1922 Sonzogni Alejandro 2008 Nuklidlerin Etkilesimli Grafigi Ulusal Nukleer Veri Merkezi Brookhaven Ulusal Laboratuvari Erisim tarihi 2013 05 03 Hult Mikael Wieslander J S Marissens Gerd Gasparro Joel Watjen Uwe Misiaszek Marcin 2009 Bir yeralti HPGe sandvic spektrometresi kullanarak 180mTa radyoaktivitesini arayin Uygulamali Radyasyon ve Izotoplar 67 5 918 21 doi 10 1016 j apradiso 2009 01 057 PMID 19246206 Dunyadan Kayip Radyoaktifler Erisim tarihi 2012 06 16 Jamin Eric Guerin Regis Retif Melinda Lees Michele Martin Gerard J 2003 Portakal Suyunda Ilave Suyun Su ve Sekerlerden Elde Edilen Oksijen 18 Oksijen 16 Izotop Oranlarinin Eszamanli Tayini ile Gelistirilmesi J Agric Food Chem 51 18 5202 6 DOI 10 1021 jf030167m PMID 12926859 Treiman A H Gleason J D Bogard D D 2000 SNC meteoritleri Mars lidir Gezegen Space Sci 48 12 14 1213 Bibcode 2000P ve SS 48 1213T DOI 10 1016 S0032 0633 00 00 105 7
 Azərbaycanca
Azərbaycanca Беларускі
Беларускі Dansk
Dansk Deutsch
Deutsch Española
Española Français
Français Indonesia
Indonesia Italiana
Italiana 日本語
日本語 Қазақ
Қазақ Lietuvos
Lietuvos Nederlands
Nederlands Português
Português Русский
Русский සිංහල
සිංහල แบบไทย
แบบไทย Türkçe
Türkçe Українська
Українська 中國人
中國人 United State
United State Afrikaans
Afrikaans
